Какво представляват вътрематочните инфекции? Дефекти на отделителната система. Вътрематочна инфекция - варицела.
Традиционно в руската литература под термина "вътрематочни инфекции"(IUI) се отнася до заболявания, при които инфекцията възниква в пренаталния период или по време на раждането и източникът е майката. Трябва да се отбележи, че вътрематочната инфекция на дете от майката се случва много по-често, отколкото се развива. Клинични признацизаболявания. За да се посочи фактът на вътрематочна инфекция в практическа медицинаизползвайте термина "вътрематочна инфекция".Срок "вътрематочна инфекция"обикновено се използва за обозначаване клинични проявленияинфекциозно заболяване на плода и новороденото, открито пренатално или малко след раждането.
Вътрематочна инфекция - рубеола
Рентгенографията на белите дробове показва микроби и мрежести сенки, плътен пулс, размити сърдечни удари. Параклинични изследвания: хемограма - левкоцитоза с фебрилитет, лимфомоноцитоза, тромбоцитопения; критично нисък общ протеин и албумин. Диагностициран неонатален сепсиспри многоорганни, респираторен дистрес синдром, тежък менингоенцефалит, мозъчен кръвоизлив. На четвъртия рожден ден детето завършва фатално. По време на раждането детето изпитва затруднения в адаптацията.
Честотата на вътрематочна инфекция.Според обобщени литературни данни най-малко 10% от новородените са инфектирани вътреутробно с различни вируси и микроорганизми. Рискът от вътрематочна инфекция зависи от вида на патогена, първоначалното здравословно състояние на бременната жена и плода, както и от епидемиологичната ситуация в определен географски регион. По-висока честота се наблюдава при първична инфекция на бременна жена, отколкото при латентна или вторична вирусна инфекция.
С интензивно интензивни грижизаписват се прогресивно влошаване, повишена жълтеница, треска и фебрилна секреция от очите. Новороденото се интубира на 30 часа и започва вентилация. В същото време се появи петехиален обрив, генерализиран оток, клонични потрепвания долни крайници, кървене от респираторен тракт. На четвъртия ден след раждането LM се изолира от кръвни култури, течности, очи, уши и трахея. Детето се консултира инфекциозен човекетиологичното лечение се променя, сърфактантът се прилага двукратно, но белодробната функция остава непроменена.
Вътрематочните инфекции са значима причинарепродуктивни загуби. По този начин честотата на ранната неонатална заболеваемост и смъртност при IUI варира от 5,3 до 27,4%, а процентът на мъртвородените достига 16,8%. В структурата на перинаталната смъртност инфекцията заема 10,1%. Още по-значима е ролята на инфекциозните възпалителни заболяванияиграят в структурата на перинаталната заболеваемост, където те представляват 20-38%.
Лечение и наблюдение за вътрематочна инфекция
Въпреки адекватната антибактериална и имуномодулираща терапия, детето остава зависимо от проветряване на стаята до 12-тия ден след раждането. Периодът на възстановяване протича бавно, детето е с намален мускулен тонус, има сукателен рефлекс, тахидиспнея, обилна секреция на горните дихателни пътища и постоянно белодробно откриване на малък мокър свистящ зъб. На 30-ия ден е написано по желание на роднини и след това е поставено в специална къща медицински грижи. Лечение: Приложена вентилация; ПАВ - два пъти; антибиотици - цефуроксим, амикацин, меропенем, фортум, ампицилин, линезолид, венозни вливанияи витамини, флуконазол, човешки албумин, 3-месечен имуновенин, плазмопреливане и кръвопреливане.
Истинската честота на перинаталната патология обаче се дължи на инфекциозен фактор, остава неуточнена, поради липса на скринингови изследвания, несъответствие между честотата на инфекцията и директната заболеваемост, често латентно протичане патологичен процес, обективна сложност на антенатален лабораторна диагностика. Като резултат
Детето се отглежда в дом за социални грижи; Отклоненията в нервно-психическото развитие са сериозни, хидроцефалията продължава и се задълбочава. Листериозата е остро инфекциозно заболяване, при което се развива септицемия. клинична картинас многоорганно увреждане с приоритетно засягане на централната нервна система при възрастни хора, а при бременни - трансплантирани тежки щетиплода, водещ до аборт или инсулт.
Ранно идентифициране на етиологичния агент и адекватно антибиотична терапияпредоставени благоприятно влияниеза листериална инфекция. Септичното състояние и отклоненията на параклиничните параметри се елиминират бързо, но неблагоприятните ефекти върху плода изискват прекъсване на бременността след медицински показания. Описаните нарушения при новородени съответстват на литературните данни. Това насочва вниманието на лекарите, че наличието на т. нар. „грипен синдром” при бременни жени също трябва да се разглежда като листериоза.
Така значителна част от инфекциите остават неразпознати и се вземат предвид в статистическия анализ като следствие от усложнения на родилния акт, вътрематочна асфиксия, респираторен дистрес синдром и други патологични състояния.
В 95,8% причините за смърт поради инфекциозен процес са състояния, настъпили в перинаталния период. От тях най-често се отбелязват: вродена пневмония 47,5%, инфекции, специфични за перинаталния период 41,6% и неонатален сепсис 6,7%.
Предотвратяване на инфекция на плода
Етиологичното уточняване и адекватната антибиотична терапия ще предпазят плода от сериозни полигонални наранявания. Принципи и практика инфекциозни заболявания. Инфекциозни заболявания и бременност. Инфекциозни заболявания на майката и вътрематочния плод. Увеличаване на случаите на листериоза във Франция и други европейски страни. Избухване на неонатална листериоза, свързана с минерално масло.
Моноцитогенна инфекция с Listeria по време на бременност - съвременни аспекти. Листериоза по време на бременност: доклад за случай. Клинична картина и изход при листериоза. Поради тази причина превенцията на предаването от майка на дете е една от важни компонентиперинатални грижи. Ето защо една от най-важните цели на перинаталните грижи е да се предотврати предаването на инфекцията от майката на новороденото.
Етиология.Списъкът на безусловните патогени е доста обширен и включва десетки видове от почти всички класове организми от вируси до протозои и гъбички.
Процент на децата, родени със симптоми бактериалнавътрематочните инфекции е 20-36%. Понастоящем е доказана ролята на широк спектър от аеробни и анаеробни бактериални агенти, предимно представители на опортюнистична микрофлора: стафилококи, стрептококи, коли, Klebsiella, Proteus, Enterobacteria, както и неспорообразуващи анаеробни микроорганизми. Трябва да се отбележи, че при тази група пациенти обикновено се откриват значителни нарушения в състава на вагиналната микробиоценоза (60-65% имат вулвовагинална кандидоза или бактериална вагиноза).
Същността на сепсиса е възпалителен отговор на тялото към инфекциозен стимул, свързан с появата на бактерии в кръвта. Повечето от тях са застрашени от кърмачето, което може да доведе до органна недостатъчност. Един от най-важните клинични изследванияе медицинска история, в която е необходимо да се оцени хода на бременността и раждането. Ранният неонатален сепсис възниква най-често между деня на живота, но изключение е дори няколко часа след раждането. Късният неонатален сепсис възниква между дните от живота.
Усложнения на неонаталния сепсис
Други усложнения на неонаталния сепсис включват респираторни, сърдечно-съдови, метаболитни усложнения, остеомиелит и други.
Превантивни и профилактични мерки за предотвратяване на инфекция
Лечение на новороденото по време на сепсис. Новородено със септична инфекция се прехвърля в междинно звено, където се наблюдава и лекува от медицински персонал. По-специално, важно е внимателното манипулиране, което улеснява възприемането на болката при това заболяване. Веднага щом здравето на новороденото се подобри, тя се връща в стаята на майката.Класическият пример за бактериална IUI е листериозата, която се причинява от Listeria monocytogenes- къси грам-положителни пръчици (кокобацили). Сред другите бактериални патогени на вътрематочна инфекция през последните години се увеличи ролята на стрептококите от група В. Тяхното значение в патологията на плода, особено на новородените, се увеличи значително на фона на широкото въвеждане на аминогликозидни антибиотици в практиката, към което тези микроорганизми са естествено устойчиви. Понастоящем е установена тясна връзка между честотата на инфекциите, причинени от стрептококи от група В при новородени, и честотата на носителство на тези бактерии в гениталния тракт на майките. Честотата на откриване на носителство на стрептококи от група В при бременни жени варира в широки граници - от 1,5 до 30%. Най-опасният е масивен фокус (повече от 10 5 CFU / ml) в цервикалния канал на майката. В такива случаи повече от 60% от новородените се раждат заразени. Клиничните прояви на инфекциите, причинени от тези бактерии при новородени са разнообразни – от локална кожа
Жените са изложени на широк спектър от патогенни агенти по време на бременност. Развитието на инфекция е толкова често, колкото и бременността. Изключение е повишен рискинфекция на плода. Някои патогенни агенти имат повишен афинитет към плацентарните трофобласти, причинявайки възпаление, последвано от инфекция на плода. Инфекцията може да настъпи пренатално, перинатално или по време на неонаталния период. Предаването на инфекциозен агент от майката на плода се нарича вертикално.
Пренаталните инфекции се класифицират на ембриопатии и фетопатии в зависимост от периода на бременността, в който възниква нарушението. Ембриопатиите се появяват през първия триместър на бременността и се характеризират с тератогенни малформации. По време на бластогенезата агентът навлиза в ембриона и обикновено умира. На етапа на органогенезата майчиният агент се прехвърля в плода по хематогенен път, но плацентата, включително фетоплацентарното кръвообращение, не е напълно развита, което ограничава трансфера на агента към плода.
до тежки фулминантни септични процеси и менингит, придружени от висока смъртност (до 80%) при недоносени новородени.
През последните години в структурата на перинаталната патология значението на ссуално-трансмисивни вътреклетъчниинфекциозни агенти: микоплазми, уреаплазми и хламидии. Честотата на вътрематочна инфекция с генитална урея- и микоплазмоза при бременни жени е 40-50%, а с хламидия достига 70,8%.
Фетопатията възниква от месеца на бременността и няма анатомични аномалии, функцията на засегнатите органи обикновено е нарушена. Предаването става по хематогенен път и малко преди и след раждането. Вътреклетъчен патогенен агент навлиза в фетоплацентарната циркулация. Феталната тератогенеза има многофакторни причини, включително генетика, лекарства и експозиция на околната среда.
Резултатът от инфекция по време на бременност може да бъде. Раждането на новородено с ниско тегло поради вътрематочно забавяне на растежа или преждевременно раждане. Тератогенна малформация – най-добре документираният тератоген е вирусът на рубеола. Активни вродени инфекции – проявява се преди раждането, като инфекциозният причинител е наличен и след раждането. Аборт, преждевременно раждане или смърт на новородено. . Пренатална инфекция. Хроничният вроден синдром се дефинира като инфекция от най-малко един месец, чиито симптоми са очевидни при раждането.
Значителна част от перинаталните инфекции се причиняват от различни вируси,сред които най-важни са цитомегаловируси, херпес симплекс, рубеола, ентеровируси (ECHO, Coxsackie), хепатит В, човешки имунодефицитен вирус. В допълнение, грип, морбили, полиомиелит, папилома и парвовируси влияят върху увеличаването на репродуктивните загуби и заболеваемостта при новородените.
Хроничният вроден синдром може да възникне като активна инфекция с признаци на активен възпалителен отговор или признаци на излекуване. Други хронични вродени инфекции могат да показват симптоми вродени аномалииили признаци на засягане на органи в резултат на инфекция.
Перинатален стрептококови инфекции. Инфекцията в миналото е била свързвана само с хирургични процедурии раждане. Основните етиологични агенти на перинаталните инфекции са стрептококите. Тези факти пораждат опасения относно риска от тежка следродилна инфекция при новородените.
През последните години се наблюдава увеличение на броя на пациентите с локални форми на херпесни лезии, което определя тенденцията към увеличаване на честотата на херпесната инфекция при новородени. Поражението на вируса на гениталиите се открива при 7% от бременните жени. Херпесът е пример за класическа хронична инфекция с доживотно съществуване на патогена в организма гостоприемник. Изолирани са около 70 типа вируси от тази група, от които 4 засягат хората: херпес симплекс вирус I и II серотипове, варицела-зостер вирус, вирус на Epstein-Barr и цитомегаловирус (и трите изолирани щама - Devis, Kerr и AD189) са клинично значение.
Тези препоръки са разработени от работна група и одобрени от Полското дружество по гинекология и Полското дружество на новородените. Болничните инфекции в миналото са били само при хирургични процедури и раждания. Основен етиологични факторитази инфекция са стрептококи.
Токсоплазмоза: характеристики на инфекцията
Това поражда голяма загриженост относно риска от сериозни перинатални инфекции при новородените. Такива насоки бяха изготвени от работна група и одобрени от Полското гинекологично дружество и Полското дружество на новородените. Периодът на новороденото е времето, когато тялото на детето, след прехода от вътреутробния към безконфликтния живот, се адаптира към новите условия. Според статистиката тя обхваща първите 28 дни от живота.
Доста често срещани сред населението са ентеровирусни инфекции. Като причинители на вътрематочни инфекции най-голям интерес представляват еховирусите и Coxsackie вирусите. Експериментът доказва етиологичното значение на Коксаки вирусите типове А 13, А 3, А 6, А 7, В 4 и В 3, както и на еховирусите 9 и 11 тип.
Специално внимание заслужават ретровирусите, причиняващи СПИН. До 50% от децата, родени от HIV-инфектирани майки, се заразяват преди раждането, по време на раждането или в ранния неонатален период. Честотата на заболяването при новородени от серопозитивни майки варира в широки граници - от 7,9 до 40%.
Чувствителността на новородените към инфекция е резултат от незрялост имунна система, особено при тези, при които често се използват инвазивни диагностични и терапевтични процедури. Терминът инфекция се разделя на. Много ранни инфекции. ранни инфекции.
Основни принципи на лечение на инфекции
инфекции късно начало. От страна на майката - кръвоток, аденом, колапс, перинатална инфекция. Перинаталните инфекции са инфекции, които възникват по време на раждане в резултат на контакт на неонаталните лигавици с микроорганизми, присъстващи в гениталния тракт на майката, така че основната причина за перинаталната инфекция е флората на матката на майката, рядко околната среда, особено болницата.
Най-високата стойност сред гъбичнипатогени на IUI имат широко разпространени представители на гъби от рода Кандида.Криптококоза, кокциоидоза, аспергилоза и хистоплазмоза при бременни жени
nyh често се появяват на фона на имунодефицит. Обръща се внимание на факта на рязко увеличаване на честотата на клиничните прояви на вагинална кандидоза по време на бременност, която III триместърдостига 31-33%. Това явление е свързано с нарушение на абсорбцията на гликоген от клетките на вагиналния епител, както и с увеличаване на образуването на муцин, което предопределя, поради ефекта на "разреждане", намаляване на концентрацията на активен фактори на локалния имунитет във вагиналната среда - лизозим, катионни протеини, среторни антитела и др. хранителни веществапод формата на гликоген, съчетани с отслабване на местния имунитет, създават благоприятни условия за прилагане на патогенния ефект на гъбичната флора. Според ДНК диагностика, по време на вагинално раждане, замърсяването на новородени от майки на пациенти с кандидоза се доближава до 100%, а до края на неонаталния период спонтанното елиминиране на гъбичките се наблюдава само при 35%, което предполага образуването на кандидоза в остатъка. Честотата на клинично изразена кандидоза при новородени през първите 35 дни достига 20-30% и въпреки лечението, след 1 месец се отбелязва при всяко пето наблюдение. гъбична инфекцияне само причинява устни, генитални и кожни проявикандидоза при новородени, но може да доведе и до вътрематочна инфекция на плода с образуването на системна микоза с дълбоко увреждане на белите дробове, мозъка, както и до спонтанен аборт (по-често през II триместър, в рамките на 14-25 седмици).
Цитомегаловирусна инфекция при новородени
Болка и нейната вътрешна среда, докато кистите се счупят. От друга страна, по пътя на майката има много микроорганизми, които могат да причинят инфекция на новороденото. Те обикновено се намират на повърхността на здрави възрастни, но при определени условия имат способността да проникват в тъканите на гостоприемника, да избягват имунните реакции и да заразяват. Основен клинични формиот тези инфекции са некротизиращ фасциит и синдром на токсичен шок. Като коменсал тази бактерия може да заема долната стомашно-чревния тракт, анус, женска вагина.
Накрая се причиняват перинатални инфекции протозои, трепонеми и рикетсии.В тази група най-важните токсоплазмоза,честотата на вътрематочна инфекция, при която е около 40%. Освен това през последните години се наблюдава тенденция към увеличаване на честотата на сифилиса. Вроденият сифилис се среща при повече от 50% от новородените от болни майки, които не са получили подходящо лечение.
Това се улеснява от високите честоти на половите съотношения. Основните патогени са полизахарид, други хемолизин и невраминидаза. Наличието на антитела срещу поликистозни антигени в серума на майката предпазва детето от инфекция. Отговорът на инфекцията е антиген-специфичен. При кърмачета инфекцията най-често настъпва по време на раждане, рядко в резултат на преждевременна кистозна фиброза.
Възпаление на костите на ембриона. Преждевременна кашлица. Инфекцията може да бъде безсимптомно носителство, ранна инфекция - най-често новородените се проявява като сепсис - менингит и инфекциозно заболяване. Ранната инфекция, проявяваща се с бързо нарастваща дихателна недостатъчност, лош неврологичен статус, хранителни аномалии и смъртност, варира от 5 до 20%. Смъртността от такива инфекции е 2-6%.
Важно е да се отбележи, че в повечето случаи вътрематочната инфекция се дължи на асоциацията на няколко патогена или е смесена (вирусно-бактериална, бактериално-гъбична). В структурата на антенаталната смъртност от вътрематочна инфекция 27,2% се падат на вирусна инфекция, 26,3% - за смесени и 17,5% - за бактериални.
През 1971 г. е идентифицирана група инфекции, които въпреки изразените различия в структурата и биологичните свойства на патогените имат подобни клинични прояви и причиняват устойчиви структурни дефекти в плода на различни системи от органи, най-важните от които са лезии на централната нервна система. За да отбележа това инфекциозна група A.J. Nahmias (1971) предлага съкращение ФАКЕЛ.Този комплекс комбинира следните вътрематочни инфекции: T- токсоплазмоза, Р- рубеола (рубеола), ° С- цитомегаловирусна инфекция, з- херпесвирусна инфекция.
През последните 15 години се наблюдава промяна в етиологичната структура на перинаталните инфекции. Това отчасти се дължи на увеличените възможности специфична диагноза, предимно микоплазмоза, хламидия, цитомегалия, херпес и стрептококова В инфекцияи др.. Съществува и истинска промяна на патогените, по-специално Listeria (Ailama-
Zyan E.K., 1995).
Въпреки широк обхватпатогени, трябва да се отбележи, че всички вътрематочни инфекции имат общи характеристики:
Латентен или изтрит курс, който значително усложнява диагнозата (особено при вътреклетъчна локализация на патогена - хламидии, микоплазми, вируси и др.) И не позволява своевременно започване на етиотропна терапия;
Активирането на латентна персистираща инфекция е възможно при всяко нарушение на хомеостазата при бременна жена (анемия, хиповитаминоза, претоварване, стресови ситуации, декомпенсация на екстрагенитално заболяване от неинфекциозен характер).
ПЪТИЩА НА ВЪТРЕМАТОЧНА ИНФЕКЦИЯ И МЕХАНИЗЪМ НА ИНФЕКЦИЯ НА ПЛОДА
Вътрематочната инфекция възниква по следните начини: "възходящ- при наличие на специфична лезия на дол
участъци от гениталния тракт (фиг. 34); „хематогенен(трансплацентарно) - в повечето случаи поради способността на някои микроорганизми да се задържат дълго време в лимфоцитите на периферната кръв;
трансдецидуален(трансмурален) - при наличие на инфекция в ендометриума;
Ориз. 34.Патогенезата на възходящата вътрематочна инфекция
низходящ- с локализирането на възпалителния фокус в областта на маточните придатъци;
*заразен- директно замърсяване на новороденото при преминаване през родовия канал;
смесен.
Бактериалната вътрематочна инфекция с опортюнистични патогени се развива главно поради възходяща инфекцияот родовия канал. Този път е характерен и за микоплазми, хламидии, гъбички от рода Кандидаи само някои вируси, по-специално херпес симплекс. Предразполагащи фактори са урогенитални инфекции, истмико-цервикална недостатъчност, частична руптура на мембрани, ненавременно изпускане на води, хорионбиопсия, амниоцентеза.
Възходящата инфекция настъпва най-бързо, когато мембраните са увредени. Амниотичната течност на жената късни датибременността имат антимикробна активност, която обаче е слабо изразена и може само да забави (но
не инхибират) растежа на микроорганизмите. Бактериостатичният ефект е много краткотраен (от 3 до 12 часа). Възпалителни променив областта на мембраните, съседни на цервикалния канал, те винаги се откриват по-рано, отколкото във вилите на плацентата. Поради ниската вирулентност на повечето опортюнистични микроорганизми, феталните мембрани остават външно непокътнати. В същото време мембраните са пропускливи за много опортюнистични микроорганизми, така че инфекцията на плода може да настъпи дори с цял фетален мехур. Причинителят прониква в амниотичната течност, настъпва интензивното му размножаване и натрупване. Образува се огнище на инфекция и плодът е в заразена среда. Така нареченият инфекциозен синдром амниотична течност.
Инфекцията на плода става чрез поглъщане и аспирация на заразени води, което води до появата на новороденото признаци на вътрематочна инфекция(пневмония, ентероколит, везикулоза, омфалит, конюнктивит и др.). В същото време микроорганизмите, разпространявайки се през мембраните или между тях, достигат базалната плоча на плацентата. (децидуит).Хорионната пластина и елементите на пъпната връв се инфектират при контакт с инфектирана околоплодна течност. По-нататъшното разпространение на възпалителната реакция води до развитие на хорионит (плацентит),което се проявява с левкоцитна инфилтрация на интервилозното пространство и ендоваскулит в хорионната пластинка. Васкулитв децидуата, стъблото и крайните вили водят до съдова облитерация, поява на инфаркти, калцификации, масивни фибриноидни отлагания, които могат да се проявят като « преждевременно узряванеплацента."
Проявите на синдрома на "инфекция на амниотичната течност", в допълнение към хорионамнионита, включват полихидрамнион,които могат да бъдат открити при 5,5-63,6% от пациентите още в края на първия триместър на бременността. Причината за неговото развитие е промяна в съотношението на процесите на производство и резорбция на амниотичната течност от клетките на амниотичния епител на фона на амнионит. олигохидрамнионпри вътрематочна инфекция обикновено е вторична и е проява на увреждане на бъбреците (намалена диуреза с плацентарна недостатъчност) или пикочните пътищаплод (обструктивна хидронефроза).
Формиране плацентарна недостатъчност.В генезиса на комплекса от симптоми на плацентарна недостатъчност при IUI, основната роля принадлежи на съдовите нарушения (васкулит и тромбоза на съдовете на феталната част на плацентата на фона на хорионит (плацентит). Промени в морфофункционалното състояние на клетката мембрани, дължащи се на активирането на липидната пероксидация на фона на плацентит, също са важни.Основните прояви на плацентарна недостатъчност са хронична хипоксия на плода и вътрематочно забавяне на растежа,която в зависимост от времето на инфекцията е симетрична (инфекция преди завършване на плацентацията) или асиметрична.
Типична проява на вътрематочна инфекция е спонтанен абортбременност. В 70% от наблюденията спонтанното прекъсване на бременността в по-късните етапи и преждевременното раждане започват с преждевременно разкъсване на плода
черупкии само в 30% - с повишаване на контрактилната активност на матката. Преждевременно развитие трудова дейности преждевременното разкъсване на мембраните се дължат на действието на бактериални фосфолипази, които задействат простагландиновата каскада и увреждащия ефект на възпалителните токсини върху мембраните.
Поради факта, че фосфолипазите на грам-отрицателните бактерии допринасят за разрушаването на сърфактанта в белите дробове на плода, новороденото развива респираторни нарушения.По този начин се изгражда следната последователност на развитие на възходяща инфекция: колпит, цервицит - инфекция на амниотичната течност - увреждане на епитела на околоплодното пространство - мембранит - амнионит на хорионната пластина - периваскулит на пъпната връв - увреждане на дихателните пътища тракт, бели дробове, храносмилателен тракти кожата - антенатална смърт на плода.
Микробиологично изследване на жени от рискови групи за развитие на IUI бактериална етиологияУстановена е идентичността на видовия състав на микрофлората на урогениталния тракт на жените и микроорганизмите, изолирани от техните деца. При новородени с клинични прояви на IUI се наблюдават масивни семена главно във вътрешните кухини (стомашно съдържимо, назофарингеални натривки). Най-често остават култури от петна от майчината повърхност на плацентата и кръв от пъпна връв
са стерилни, а амниотичната течност и плодната повърхност на плацентата имат най-висок резултатмикробна колонизация. Това доказва преобладаващо възходящия път на инфекция на плода и водещата роля на амниотичната течност при инфекция на плода.
За хематогененинфекцията на плода е най-характерна за наличието на огнище в тялото на майката, разположено екстрагенитално. Причинителят, нарушавайки плацентарната бариера, прониква в кръвния поток на плода. При хематогенна инфекция често възниква генерализирана лезия на тялото на плода - вътрематочен сепсис. Всички истински вродени вирусни инфекции, микоплазмоза, хламидия, както и такива специфични вътрематочни инфекции като листериоза, сифилис и токсоплазмоза имат трансплацентарен път на инфекция.
Хематогенният път се характеризира с преобладаване на васкулит на плацентарното маточно легло, след това - развитие на интервилузит, васкулит на хорионната плоча, след това - флебит и ендартериит на пъпната връв, инфекция на черния дроб, мозъка, увреждане на други органи на плода – антенатална смърт.
За изпълнение трансдецидуален (трансмурален)пътят на инфекцията изисква наличието на огнище на инфекция под ендометриума. Подобен път на инфекция на плода най-често се среща при пациенти, които са имали гнойно-възпалителни заболявания на гениталните органи.
ОТ низходящчрез вътрематочна инфекция, при която проникването на патогена в феталното яйце става през фалопиевите тръби, в клиничната практика трябва да се работи с пациенти с остра хирургична патология на органите коремна кухина, остър или хроничен салпингоофорит с гонореална, микоплазмена или хламидиална етиология. Класическият пример е остър апендицит, докато механизмът на увреждане на плода наподобява този на възходящата инфекция.
ИМУННА СИСТЕМА НА ПЛОДА
Зрелият имунен отговор включва сложна последователност от взаимодействия между няколко типа клетки. Процесът на узряване на отделните клетки, участващи в имунния отговор, започва в ранните етапи от живота на плода. Прогениторните клетки на човешката имунна система се произвеждат в костния мозък и черния дроб на плода. Маркерите за хистосъвместимост и антигените, характерни за Т- и В-лимфоцитите, могат да бъдат открити върху лимфоцитите още на 8-10-та гестационна седмица. Тъй като клетките на имунната система узряват върху макрофагите, както и върху Т- и В-лимфоцитите, се появява все по-голям брой рецептори и маркери за хистосъвместимост, но пълното съзряване завършва едва приблизително 2 години след раждането.
В типичните случаи може да се наблюдават реакции към инфекциозни агенти, които преминават през плацентата още през втората половина на бременността. Този вид имунен отговор обикновено се проявява под формата на образуване на антитела от клас IgM, но могат да се образуват и антитела от клас IgG. Идентифицирането на феталния имунен отговор под формата на IgG антитела е по-трудно поради наличието на пасивни майчини IgG антитела.
Майчините IgG антитела започват да преминават през плацентата около средата на бременността. По време на раждането концентрацията на IgG в кръвта на детето (главно майчини имуноглобулини) е равна на съответната концентрация в кръвта на майката или дори я надвишава. Това означава, че детето има всички IgG антитела, образувани в тялото на майката. Майчините IgA и IgM антитела не преминават през плацентата и ако антитела от тези класове се открият при дете, това означава, че те са се образували в тялото на детето.
Образуването на IgA антитела често не е напълно установено до момента на раждането. Доказано е, че пълното развитие на тази система може да продължи през първите седем години от живота. По този начин основният източник на имунитет в плода е прехвърлянето на майчините IgG антитела през плацентата, въпреки че вече в доста ранен стадий на развитие неговата имунна система е в състояние да развие своя собствена защита.
Трудностите при изучаването и тълкуването на резултатите от изследването на хуморалния и клетъчния имунитет при майката и феталния плод доведоха до търсенето на нови решения за оценка на имунореактивността
на фона на инфекциозен процес по време на бременност. По този начин ние оценихме редица про- и противовъзпалителни цитокини (интерферони, интерлевкини, фактор на туморна некроза) в различни периоди на бременност в плода, майката и новороденото. Тъй като цитокините и интерфероните са универсални регулатори на всички имунни реакции, както клетъчни, така и хуморални, тяхното изследване позволява решаването на най-важния клиничен проблем - има ли инфекция в плода и необходимо ли е да се предписва лечение? Доказано е, че намаляването на нивото на интерлевкин-4 в комбинация с повишаване на концентрацията на гама-интерферон и фактор на туморна некроза в кръвта на майката показва наличието на вътрематочна инфекция в 86,4%. Такива изследвания позволяват неинвазивна оценка на риска от инфекция при новородено.
Патогенеза.В патогенезата на вътрематочната инфекция на плода значителна роля се дава на прякото взаимодействие на патогена и плода. Обхватът на уврежданията, открити по време на вътрематочна инфекция, е много широк и зависи от характеристиките на морфогенезата и реакциите на плода в определен период на вътрематочно развитие, специфичните свойства и продължителността на увреждащия фактор.
Връзката между вирулентността на патогена и тежестта на увреждането на плода не винаги е правопропорционална. Често изтрити течове или лека инфекцияв майката, причинени от токсоплазма, листерия, микоплазми, хламидии, вируси или гъбички от рода Кандидаможе да доведе до смърт на плода или раждане тежко болно дете. Този факт се дължи на тропизма на патогените към определени ембрионални тъкани, както и на факта, че феталните клетки с висока метаболитна активност представляват благоприятна среда за възпроизвеждане на микроби.
Увреждащият ефект на бактериален инфекциозен агент може да се реализира чрез развитието на разрушителен възпалителен процесв различни органи с образуване на структурен или функционален дефект и чрез директно тератогенно действие с образуване на устойчиви структурни променипод формата на дефекти в развитието. Вирусните агенти обикновено причиняват летални разстройства или дефекти в развитието чрез потискане на митотичното клетъчно делене или чрез директни цитотоксични ефекти. Възстановителни процеси, които се развиват след възпаление
Ям, често водят до склероза и калцификация на тъканите, което също нарушава процеса на хистогенеза.
Периодът на ембриогенезата обхваща първите 3 месеца от бременността, а най-чувствителната фаза към въздействието на увреждащите фактори е първите 3-6 седмици от органогенезата (критичният период на развитие). По време на имплантирането чувствителността към действието на увреждащите фактори се увеличава значително. Инфекциозните ембриопатии, които се появяват по това време, се характеризират с появата на деформации (тератогенен ефект), по-рядко се наблюдават ембриотоксични ефекти. На първо място се засягат тъканите, които са били в процес на активна диференциация по време на действието на агента. При различни телапериодите на отметките не съвпадат във времето, така че продължителността на излагане на увреждащия агент ще зависи от множеството лезии.
С началото на ранния фетален период плодът развива специфична чувствителност към патогени на вътрематочни инфекции. Лезиите на плода, които се появяват след 13 седмици, се наричат "фетопатии". При фетопатия със септична етиология е възможно образуването на малформации. Морфологичната основа за това са алтеративни и пролиферативни процеси, водещи до заличаване или стесняване на естествените канали и отвори. Такива промени водят до нарушаване на по-нататъшното развитие на вече образуван орган. Така инфекцията на пикочните пътища може да доведе до хидронефроза, прехвърленият менингоенцефалит - до хидроцефалия на фона на стесняване или заличаване на Силвиевия акведукт.
При заразяване след 27 гестационна седмица плодът придобива способността да реагира специфично на въвеждането на инфекциозния агент с левкоцитна инфилтрация, хуморални и тъканни промени. Увреждащият ефект на инфекциозния агент се реализира в този случай под формата на функционални дефекти.
Трябва също да се отбележи, че важни връзки в патогенезата на IUI са интоксикация с метаболитни продукти на инфекциозния агент, хипертермия и хипоксемия. Влиянието на горните фактори върху вътрематочния плод се проявява чрез забавяне на растежа и диференциацията на белите дробове, бъбреците и мозъка, дори при липса на други прояви на вътрематочна инфекция.
Клинични признацивътрематочно инфекциозно заболяване при новородено, или вече присъства при раждането, или манифест
lyatsya през първите 3 дни от живота (най-често на 1-2-ри ден). При заразяване в постнаталния период симптомите на инфекциозния процес се откриват на по-късна дата. По-дълъг инкубационен период е възможен при вътрематочна инфекция („късен“ менингит, остеомиелит, хламидиални лезии и др.) Или, напротив, ранни прояви на нозокомиална инфекция (особено при недоносени бебета).
Най-честата клинична изява на бактериална вътрематочна инфекция при новородени в първите дни от живота е т.нар. инфекциозен синдром.Такова дете има общи клинични симптоми, отразяващи признаци на интоксикация и изразяващи се в обща летаргия, намален мускулен тонус и рефлекси (по-специално сукателния рефлекс), регургитация, отказ от гърдата. Отстрани на сърдечно-съдовата система- глухота на сърдечните тонове, промени в ЕКГ с хипоксичен характер. Палор отбеляза кожата, нарушение на ритъма и честотата на дишане, пристъпи на цианоза. Инфекцията може да доведе до развитие на септичен процес, за осъществяването на който е важно състоянието на новороденото в първите часове от живота и дозата на патогена. Недоносеността, нарушеното дишане и хемодинамика, вътречерепното увреждане, хипоксията допринасят за намаляване на устойчивостта на тялото на новороденото и са благоприятният фон, на който инфекцията става изразена, придобивайки характера на септичен процес.
Специфичните прояви на вътрематочните инфекции при новородени са различни - от леки локални форми до тежки септични.
Клиничните прояви на вродени бактериални или микотични кожни лезии при новородено могат да бъдат везикулопустулоза.Процент положителни резултатимикробиологичното изследване на съдържанието на везикули, взето веднага след раждането на дете, е ниско, така че е спорно дали да се припишат "асептични" везикули на вродена инфекция или да се разглежда като проява на бактериална алергия с поява на обрив върху кожата. Истинската (микробиологично потвърдена) везикулопустулоза се проявява при пренатално заразени деца, обикновено до края на 1-вия и на 2-рия ден от живота, като причинителите най-често са стрептококи.
ki групи B и D, Escherichia, дрождеподобни гъби (Ankirskaya A.S. et al., 1989).
Конюнктивит, ринит и отит,се появи на 1-3-ия ден от живота, също може да бъде проява на вътрематочна инфекция. При вроден конюнктивит, освен микробиологично изследване на секрет от очите за опортюнистични микроорганизми, е необходимо да се вземат цитонамазки за изследване за гонококи.
Вътрематочна пневмония- най-честата форма на вродени инфекции на новороденото. При деца от момента на раждането се наблюдават признаци на дихателна недостатъчност: задух, цианоза, често притъпяване на перкуторния звук и малки бълбукащи мокри хрипове. Рентгеновото изследване, проведено в първите часове от живота, потвърждава наличието на огнища на пневмония. Вродена аспирационна пневмония може да се появи и на 2-рия или 3-ия ден от живота. При микробиологично изследване на аспират от трахеобронхиалния тракт при новородени с аспирационна пневмониянай-често се изолират грам-отрицателни бактерии, докато при придобита в болница неонатална пневмония най-често се изолира Staphylococcus aureus. Протичането на вродена пневмония е тежко, тъй като в резултат на аспирация големи участъци от белия дроб (долни и средни лобове) се изключват от дишане поради бронхиална обструкция с аспирационни маси - инфектирана амниотична течност, съдържаща примес на мекониум, кожа на плода везни.
Ентероколитпри новородени може да има характер и на вътрематочна инфекция, когато патогенът прониква заедно с амниотичната течност в стомашно-чревния тракт. Следните клинични прояви са характерни за вроден ентероколит: бавно сукане, регургитация, подуване на корема, уголемяване на черния дроб и далака, разширяване на венозната мрежа на предната коремна стена, често срещан течни изпражнения. Диспептичните симптоми обикновено се развиват на 2-3-ия ден от живота. Важно е микробиологичното изследване на чревното съдържимо (признаци на нарушение на образуването на чревна микроценоза - количественото преобладаване на Klebsiella, Proteus, Pseudomonas aeruginosa).
Поражението на центр нервна системас IUI при новородени може да бъде както първичен (менингит, енцефалит), така и вторичен, дължащ се на интоксикация. Проникване възбужда-
la в мозъка на плода най-често се появява по пътищата на CSF, така че инфекцията се развива в мембраните на главата и гръбначен мозъки тече във формата менингити менингоенцефалит.Има и промени в хороидните плексуси на страничните вентрикули на мозъка, които могат да бъдат придружени от развитие на вродена хидроцефалия.
сепсиспри новородено е трудно да се диагностицира поради ниската реактивност на тялото му. В началото на заболяването клиничните прояви могат да бъдат леки, може да има само признаци на обща интоксикация, без очевиден фокус на инфекция (синдром на "инфекция"). Необходимо е да се обърне внимание на такива симптоми като летаргия, лошо сукане, регургитация, забавено възстановяване или вторична загуба на тегло, забавено зарастване на пъпната рана, развитие на омфалит. Характерни симптоми на инфекциозна интоксикация при новородено са респираторни и тъканни метаболитни нарушения. Има бледо цианотичен, със сивкав оттенък, цвят на кожата с ясно изразен съдов модел (мрамор на кожата). Интоксикацията е придружена от нарушение на екскреторната функция на черния дроб, развитие на продължителна жълтеница. Симптомите на сепсис включват също уголемяване на далака и периферните лимфни възли. Информационни признаци са оток подкожна тъкан, хипохромна анемия, дисфункция на бъбреците и черния дроб, водно-солев и протеинов метаболизъм (хипопротеинемия) (Ankirskaya A.S. и
и др., 1989).
Трябва също да вземете предвид неспецифични проявивътрематочна инфекция. При новородени от тази група реакциите на адаптация на такива жизненоважни важни системикато централна нервна, респираторна, сърдечно-съдова, ендокринна и имунна. Често има нисък резултат по Апгар в първата минута след раждането. Често в ранния неонатален период има неуспехи в адаптацията под формата на хипоксичен синдром, синдром на респираторни и сърдечно-съдови нарушения, надбъбречна и церебрална патология. Трябва да се има предвид възможността за такива прояви като вродено недохранване, едематозен синдром, хипербилирубинемия, кръвен синдром на DIC.
ПРЕНАТАЛНА ДИАГНОСТИКА НА ВЪТРЕШНИ ИНФЕКЦИИ
Като се има предвид неспецифичността на клиничните прояви на тази патология, нейната пренатална диагностика е най-трудна.
Най-рационално е поетапното диагностициране на вътрематочните инфекции.
На първи етапвъз основа на събиране на анамнестични данни и общ клиничен преглед се определя група с висок риск за развитие на вътрематочни инфекции. Тази група включва пациенти:
Наличие на екстрагенитални огнища на инфекция, особено при обостряне на инфекциозния процес по време на бременност, както и тези, които са преживели остри респираторни вирусни инфекции по време на бременност;
ОТ ранен стартсексуален живот и честа смяна на сексуални партньори, които са имали епизоди на урогенитални инфекции;
Тези, които са имали възпалителни заболявания на матката и нейните придатъци, колпит, полово предавани болести;
Изкуствено прекъсване на бременността със сложно протичане на периода след аборта;
ОТ спонтанно прекъсванебременност по всяко време в историята;
Със сложен курс следродилен периодслед предишни раждания;
При инфекциозни и възпалителни заболявания на гениталните органи (колпит, бактериална вагиноза) по време на бременност;
C истмико-цервикална недостатъчност;
С клинични признаци на полихидрамнион или фетоплацентарна недостатъчност.
На втори етапчрез цялостна ултразвуково изследванеидентифициране на ехографски маркери на вътрематочни инфекции, както и признаци на фетоплацентарна недостатъчност и оценка на нейната тежест.
Сонографските признаци, показващи IUI, могат да бъдат разделени на следните групи.
1. Патология на амниона и хориона: - полихидрамнион или олигохидрамнион (може да се диагностицира от края на първия триместър на бременността);
Хиперехогенна суспензия в амниотичната течност;
Амниотични ленти;
Патология на вилозния хорион - хипоплазия на въси (може да се диагностицира по време на бременност до 8-9 седмици и се проявява чрез изтъняване на хориона около цялата обиколка до 1-3 mm, намаляване на неговата ехогенност, прекъсване и гладкост на външния контур);
Плацентит, чиито признаци са оток / удебеляване (71,8%), хетерогенна ехогенност на паренхима на плацентата, удебеляване / удвояване на контура на базалната плоча, замъгляване на границите на лобулите, неравномерно разширяване на междинните пространства и субхорионното пространство ;
Преждевременно узряване на плацентата.
2. Коремни и подкожни отоци:
Неимунна воднянка (подкожен оток и плеврален и/или перикарден излив или асцит);
Хидроторакс;
Двустранен плеврален излив.
3. Калцификации във вътрешните органи на плода:
Калцификации на перивентрикуларната област;
чревни калцификации;
Паренхимни калцификации на черния дроб/слезката.
4. Промяна в ехогенността вътрешни органиплод:
Хиперехогенни черва (признак има диагностична стойностслед 16 седмици от бременността);
Чревна пневматоза (открива се в 25% от случаите с IUI);
Мехурчета с газ в жлъчния мехур;
Хиперехогенни големи бъбреци нормални размериПикочен мехур;
Двустранно повишаване на белодробната ехогенност (в комбинация с лек плеврален излив и полихидрамнион е признак на вътрематочна пневмония).
5. Структурни дефекти (малформации на вътрешните органи на плода).
6. Хепатомегалия и спленомегалия.
Откриването на ехографски маркери на IUI не може да служи като основа за диагноза. Отбелязахме, че при комбинация от три ехографски признака и повече вероятността от вътрематочна инфекция за новородено достига 80%.
При оценката на фетометричните параметри се извършва диагностика на синдрома на забавяне на растежа на плода (FGR) и се определя неговата форма. Доплеровото изследване на кръвния поток в съдовете на фетоплацентарния комплекс дава възможност да се открият нарушения, които при IUI се откриват предимно във фетално-плацентарния кръвен поток. Кардиотокографското изследване позволява да се диагностицират признаци на развитие на фетална хипоксия.
Успоредно с ултразвукова диагностикапроведе цялостен преглед с помощта на модерни лабораторни методиизследване за идентифициране на патогени на инфекциозни заболявания в тялото на жената.
1. Ензимен имуноанализ, базиран на определяне на IgM и IgG, специфични за определена инфекция, или антигени на съответните патогени.
2. Метод на молекулярна хибридизация (идентификация на ДНК или РНК фрагменти на патогенни клетки).
3. ELISA метод (определяне на моноклонални антитела в телесни течности и среди чрез тест система).
4. Бактериоскопско изследване на нативни и оцветени по Грам цитонамазки от уретрата, цервикален канали вагината.
5. Бактериологично изследване с инокулация на съдържанието на цервикалния канал, уретрата и вагината върху течни и твърди среди, за да се определи количествено представителите на аеробни и анаеробни инфекции и тяхната чувствителност към антибактериални лекарства.
6. Изследване на изстъргвания от цервикалния канал чрез полимеразна верижна реакция за идентифициране на патогени на полово предавани болести.
На трети етапслед използване на индиректни диагностични методи и получаване на данни, показващи наличието на вътрематочна инфекция, е възможно да се използват методи за директна диагностика на IUI в материала, получен от биопсия на хорион, амниоцентеза и кордоцентеза.
За диагностика на вътрематочни инфекции при I триместърбременността е най-удобната трансцервикална аспирация биопсия на хорионни вили.Произвежда се от 6 до 10 седмица от бременността под контрола на ултразвуковото сканиране. Полученият биопсичен материал се подлага на бактериологични и вирусологични изследвания и се извършва кариотипиране. При
откриване на вътрематочна инфекция, трябва да се повдигне въпросът за прекъсване на бременността, тъй като за инфекция в ранни датихарактеризиращ се с образуването на малформации на плода.
От 16-та седмица на бременността и през цялото време II триместърИзползва се за диагностициране на вътрематочна инфекция амниоцентеза.Операцията се извършва при асептични условия трансвагинално (през предната или заден форниксвагинален или трансцервикален) или трансабдоминален достъп (използван по-често). Под контрола на ултразвуковото сканиране се извършва пункция на амниотичната кухина в джоба на околоплодната течност, свободен от бримки на пъпната връв и малки части на плода. За изследването се вземат три проби околоплодна течност с общ обем 24 ml, които в последствие се подлагат на микробиологично, биохимично и генетично изследване.
Съществуват редица тестове, предназначени за откриване на вътрематочни инфекции в амниотичната течност: газово-течна хроматография амниотична течностза определяне на органични киселини (ацетат, сукцинат, бутират, оксалоацетат и др.), което е специфично за наличието инфекциозни агентив амниотичната течност.
Те също така използват бактериоскопия на нативни и оцветени по Грам петна от амниотична течност, като ги засяват върху течни и твърди среди. Откриването в културата на етиологично значими микроорганизми в количество над 5 × 10 2 CFU / ml е диагностичен критерийвътрематочна инфекция.
При диагностицирането на вирусни вътрематочни инфекции се използва култивирането на вирусни агенти върху пилешки ембриони и полимеразната верижна реакция.
Важна роля принадлежи на серологичните методи на изследване, най-чувствителният и специфичен от които е определянето на моноклонални антитела чрез тестовата система ELISA.
Дейността се определя алкална фосфатазалевкоцити в кръвта на пъпната връв, преброяване на броя на тромбоцитите (тромбоцитопения под 150-10 9 / l се счита за признак на инфекция), съотношението на младите форми на левкоцити и неутрофили и радиоизотопно определяне на β-лактамаза (типично за инфекция с β- микроорганизми, произвеждащи лактамаза). Кръвта също се подлага на бактериологични, вирусологични и имунологични изследвания.
Предклиничната диагностика на IUI се основава основно на целево микробиологично изследване на новородени (непосредствено след раждането) и хистологично изследване на плацентата при бременни жени с повишен риск от инфекция на плода.
За разлика от микробиологичните и хистологичните методи, имунологичното изследване на новородени по време на раждането, по-специално определянето на основните класове имуноглобулини в кръвта от пъпна връв, не е достатъчно информативно за предклиничната диагноза на IUI. Това се дължи на факта, че едни и същи стойности на имуноглобулини G, M, A се записват при новородени със и без клинични прояви на инфекция. Повишеното ниво на IgM в кръвта от пъпната връв отразява антигенната стимулация, настъпила в антенаталния период, но не винаги показва наличието на инфекциозен процес.
ХАРАКТЕРИСТИКИ НА ИНДИВИДУАЛНИ НОЗОЛОГИЧНИ ФОРМИ НА ВЪТРЕМАТОЧНИ ИНФЕКЦИИ
Цитомегаловирус
Цитомегаловирус (CMV) - ДНК-съдържащ вирус от семейството на херпесните вируси, е повсеместно разпространен и може да се предава с различни телесни секрети (кръв, урина), но най-често чрез полов контакт. При възрастни инфекцията по правило протича без явни клинични прояви, но е възможно и нейното мононуклеозноподобно протичане.
CMV инфекцията възниква при близък контакт със заразен човек или чрез възходяща инфекция от майка на дете. Вирусът понякога се отделя в слюнката, урината и гениталните секрети и се предава чрез целувка, полов акт или друг контакт.
Цитомегаловирусът, след като веднъж влезе в човешкото тяло, след първичната инфекция не се елиминира във външната среда, но остава в нея за цял живот. Дългосрочният латентен ход на инфекцията се улеснява от вътреклетъчното съществуване на вируса, където той е надеждно защитен от действието на специфични антитела. Серологичните изследвания, проведени в Русия, показват, че 90% от бременните жени имат антитела срещу CMV, което показва изключително висока
com ниво на вирусоносителство. По време на бременността се създават реални условия за реактивиране на инфекцията, което е свързано с гестационните особености на функционирането на имунната система (състояние на физиологична имуносупресия).
Вероятността от вътрематочна инфекция на плода с латентен ход на инфекцията практически липсва, с реактивирането му е 0,5-7%, а с първична инфекция надвишава 40%. Общата честота на пренатална CMV инфекция е 5-20 на 1000 живородени. Пренаталната инфекция с цитомегаловирус е 5% при серопозитивни жени, до 20% от инфекциите възникват по време на раждане, а други 10% от децата се заразяват в ранния постнатален период - най-често от майката, чрез замърсено майчино мляко.
Най-честият път на заразяване е трансплацентарно, по-рядко плодът поглъща инфектирана околоплодна течност при наличие на плацентит и хориоамнионит.
Вирусът може да зарази всеки орган на плода, включително централната нервна система. Инфекцията на епителните клетки се характеризира с развитието на големи интрануклеарни включвания (цитомегални включвания). В засегнатите тъкани се наблюдава цитолиза с области на фокална некроза и предимно мононуклеари. възпалителна реакция. Заздравяването води до фиброза и калцификация, особено в субепендималната мембрана на мозъчните вентрикули и в черния дроб. тежък церебрални усложнения, включително микроцефалия и калцификация, обикновено са резултат от вътрематочна инфекция през първите 3-4 месеца от бременността, когато вентрикуларната система е в процес на развитие.
Във връзка с поражението в ранните етапи на бременността се формират ембриопатии, развиват се тежки трофични нарушения гестационен сак, настъпва смърт на ембриона или плода, бременността завършва със спонтанен аборт. Мъртвите фетуси се характеризират с тежки церебрални нарушения, включително микроцефалия, хидроцефалия и калцификация, поренцефалия, панкреатична цистофиброза, цироза на черния дроб, атрезия на жлъчните пътища, кортикална дисплазия на бъбреците също могат да бъдат отбелязани.
В по-късните периоди се образуват фетопатии с фетоплацентарна недостатъчност, вътрематочно забавяне на растежа и се появяват стигми на дисембриогенеза. Новородените имат епителни лезии слюнчените жлези, извити тубули на бъбреците, бронхите, жлъчката
канали. Според цялостно (сонографско, доплерово и кардиотокографско) изследване (хормони - плацентарен лактоген, прогестерон, естриол, кортизол; съдържание на AFP) - признаци на вътрематочно страдание на плода се установяват при 33,9%.
Клинични проявления. 90-95% от бебетата, заразени с CMV in utero, нямат симптоми при раждането. Повечето от тях се развиват нормално, но внимателното проследяване за дълъг период от време показва, че 10-30% от децата впоследствие развиват симптоми на леки неврологични увреждания - нервна глухота, забавено развитие или лека умствена изостаналост. Освен това е възможно специфично нарушение на функцията на клетъчния имунитет - инхибиране на активността на Т-хелперите, повишаване на съдържанието на IgM и IgG.
При малка част от децата с клинични признаци на инфекция те варират от вътрематочно забавянерастеж (открива се най-често като увеличение на черния дроб и далака) или засягане в процеса на отделен орган до тежка, генерализирана, животозастрашаващазаболяване, което е рядко.
Много от екстрагениталните прояви на вродена цитомегаловирусна инфекция (хепатит, тромбоцитопения, хемолитична анемияи пневмония) изчезват за определен период без лечение. Неврологичното увреждане е необратимо, въпреки че степента на увреждане варира. Повечето деца с вродени цитомегаловирусна инфекциядеца, родени със симптоми на увреждане на нервната система, страдат от сериозни необратими неврологични заболявания, включително церебрална парализа, епилепсия и нервна глухота. Хориоретинопатията е доста често срещана. Рядко причинява някакъв дефект в зрението и е удобен диагностичен признак при съмнения за вродени инфекции, въпреки че е неразличим от хориоретинопатия, дължаща се на токсоплазмоза. Смъртността при вродена цитомегалия е 20-30%.
Профилактика и лечение.Към днешна дата не са разработени ефективни безопасни ваксини или препарати от готови специфични моноклонални антитела. Превантивните мерки се свеждат до изолиране на заразени новородени и изключване на контакт на тези новородени със серонегативни бременни жени. Персоналът, който се грижи за тях, работи с ръкавици и втори
халат за баня. Като пасивна профилактика можете да използвате въвеждането на препарати от готови антитела с високо съдържаниеантицитомегаловирус IgG.
Въпреки скорошния напредък в лечението на инфекции, причинени от α-херпесвируси (херпес симплекс вирус и варицела-зостер вирус), лечението на β-херпесвирусни заболявания не е окончателно разработено. Използват се валацикловир и ганцикловир, но няма достатъчно опит с приложението им при бременни жени. Комплексът от лечение включва използването на растителни адаптогени (елеутерокок, женшен, пчелно млечице), витамини от група В (В 1, В 6, В 12) до 14 гестационна седмица.
Започвайки от 15-16 седмици като метод за палиативно лечение, се провежда курс на имуноглобулинова терапия с нормален човешки имуноглобулин или препарати от готови антитела с високо съдържание на антицитомегаловирусни IgG - антицитомегаловирусни имуноглобулини. С въвеждането на имуноглобулинови препарати тялото на майката получава готови антитела (AT) срещу CMV. Abs от клас IgG активно преминават през плацентата и създават пасивен имунитет в плода. В тялото на бременна АТ те блокират извънклетъчно разположените вируси, създават имунни комплекси с тях, насърчават елиминирането им от тялото и ограничават разпространението им в лимфната и кръвообращението. Имуноглобулиновата терапия се провежда, като се има предвид рискът от алергични, пирогенни реакции, производството на анти-y-глобулини, обостряне на инфекцията, т.е. в ситуации, при които рискът от неблагоприятни последици от инфекция е по-висок.
Получените данни за намалената способност на левкоцитите да произвеждат α- и y-интерферон при жени с вирусни инфекции показват целесъобразността на включването на имуномодулиращи и интерферон-коригиращи компоненти в комплексната терапия на бременни жени с цитомегаловирусна инфекция. Използва се генетично модифицирано рекомбинантно лекарство viferon, което е a2-интерферон, свързан с антиоксиданти. Има интерферон-стабилизиращи, имуномодулиращи и антиоксидантни свойства.
Новото в лечението на херпесните инфекции е използването на плазмафереза и ендоваскуларно лазерно облъчване на кръвта (ЕЛОК). Терапевтичната ефикасност на плазмаферезата и ELOK се дължи на детоксикиращия ефект, стимулиращ ефект върху
клетъчни и хуморален имунитети реакции на неспецифична резистентност, нормализиране на коагулационните и агрегационните свойства на кръвта.
херпетична инфекция
Най-важна роля играят вирусите от семейството herpesviridae.Вирусът на херпес симплекс (HSV) е ДНК-съдържащ и принадлежи към същата група като CMV, Вирус на Епщайн-Бари вирус шарка- херпес зостер. Идентифицирани са два от неговите серотипове HSV-1 (оролабиален) и HSV-2 (генитален), но няма пълно съответствие между серотипа и локализацията на инфекцията. При 20% от неонаталните инфекции тя е свързана с генитална HSV-1 инфекция.
Вирусът на херпес симплекс се предава различни начини, най-важен е сексуалният път. Поражението на вируса на гениталния херпес се открива при 7% от бременните жени. Херпесът при новородени се регистрира с честота 1: 2000-1: 5000, но въпреки относителната рядкост на неонаталния херпес, тежестта на неговите прояви и неблагоприятната прогноза за новороденото правят много важно да се разработят рационални подходи към диагнозата. , лечение и по-специално профилактика на това изключително тежко заболяване.
Честотата на откриване на HSV-2 варира значително в зависимост от редица фактори (възраст, естество на сексуалната активност, социално-културно ниво на населението и др.). Така при юноши под 15-годишна възраст серопозитивните резултати са по-малко от 1%, докато сред пациентите на клиники, специализирани в полово предавани болести, те варират от 46-57%. При бременни жени специфични антитела срещу HSV-2, например в САЩ, се откриват средно при 20-30% от жените.
Клиничните прояви на първична инфекция при майката продължават 18-22 дни, като симптомите се засилват през първата седмица. През следващите 2 седмици се наблюдава асимптоматична десквамация на увредения от вируса епител. Общата продължителност на проявите е почти 6 седмици. Непървичната генитална инфекция е по-слабо изразена: продължителността на клиничните прояви е по-кратка (около 15 дни), асимптоматичното отделяне на вируса е по-рядко и продължителността му намалява до 8 дни. Тежестта и продължителността на клиничните прояви при рецидиви е още по-слабо изразена, а продължителността на десквамация на увредения епител е само 4 дни.
Първичен генитален херпес при майката и екзацербация хроничен процесса най-опасни за плода. Ако 0,5-1,0% от новородените са заразени интранатално, тогава с остро протичанеили екзацербация, която се проявява с везикулозни лезии на кожата и лигавиците на гениталиите, рискът от инфекция на плода по време на раждането достига 40%.
При вътрематочна HSV-2 инфекция в повечето случаи инфекцията на плода настъпва непосредствено преди раждането, възходяща след разкъсване на мембраните (критичен период 4-6 часа) или по време на раждане при преминаване през заразени родовия канал(85%). Предаването на инфекцията става както при наличие на лезии в шийката на матката и вулвата, така и при асимптоматична изолация на вируса. При възходящ път на инфекция, патогенът се размножава и се натрупва в околоплодната течност, отбелязва се полихидрамнион. Веднъж възникнала инфекцията, вирусът може да се разпространи чрез контакт или хематогенен път. При 5% трансплацентарното разпространение става по време на бременност.
Поражението на плацентата и плода с херпесна инфекция може да възникне на всеки етап от бременността и да доведе до образуване в плода рожденни дефектиразвитие, пренатална смърт, спонтанен аборт или преждевременно раждане. Инфекцията през първия триместър води до образуване на хидроцефалия, сърдечни дефекти, аномалии на стомашно-чревния тракт, често се случва спонтанен аборт и се развива вътрематочно забавяне на растежа. През II и III триместър инфекциозен процесводи до развитие на хепатоспеленомегалия, анемия, жълтеница, пневмония, менингоенцефалит, сепсис, недохранване. Вътрематочната инфекция в края на бременността се проявява ранно развитиеклинична картина на неонатална инфекция (първи ден) при деца, родени дори в резултат на цезарово сечение. Чести прояви на херпетична инфекция: увреждане на кожата, устната лигавица, хориоретинит.
Неонаталната херпесвирусна инфекция се проявява в три клинични форми.
Локална форма с лезии на кожата и лигавиците- 45%. Най-чести, но и най-чести са уврежданията на кожата и лигавиците лека форманеонатален херпес. Очи: кератоконюнктивит и хориоретинит. Кожа и устна лигавица: везикули,
еритема, петехии. Ако не се лекува, заболяването може да прогресира с развитието на тежки усложнения. Смъртността е около 18%.
Локална форма с увреждане на ЦНС(енцефалит) - 35%. Характерни: треска, летаргия, намален апетит, синдром на депресия или възбуда, тремор, конвулсии. Откриват се изразени промени в цереброспиналната течност. Смъртността при липса на терапия е повече от 50%.
Разпространена форма- двадесет процента. При дисеминирана форма на неонатален херпес обикновено в процеса участват няколко органа наведнъж: черен дроб, бели дробове, кожа, надбъбречни жлези. Признаците се появяват на 1-2-та седмица от живота, включват симптоми на локализирана форма в комбинация с анорексия, повръщане, летаргия, треска, жълтеница, респираторни нарушения, кървене, шок (фиг. 35). Началото на кървене и съдов колапс може да бъде внезапно и бързо фатално. Смъртността при тази форма е изключително висока – 90%. Съвременната антихерпетична химиотерапия може значително да подобри прогнозата, но въпреки продължаващото лечение, рискът от дългосрочни неврологични разстройства остава доста висок.
Оцелелите деца в бъдеще имат тежки усложнения (неврологични разстройства, зрителни увреждания, психомоторна изостаналост).
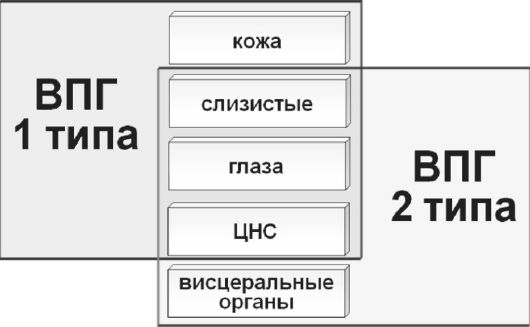 Ориз. 35.Тъканен тропизъм на херпесните вируси
Ориз. 35.Тъканен тропизъм на херпесните вируси
Профилактика, лечение и водене на бременност.Същността на превантивните и медицински мерки, както и акушерските тактики, зависят от вида, формата (типични, атипични, безсимптомни и продължителността на курса) и наличието на лезии на гениталиите, състоянието на мембраните.
При първична инфекция в ранните етапи на бременността е необходимо да се повдигне въпросът за нейното прекъсване. Ако заболяването се появи късно или жената е била заразена преди бременността, превантивните мерки включват динамично ехографско наблюдение на развитието и състоянието на плода, предписване на курсове на терапия, включително метаболитен комплекс, стабилизатори на клетъчната мембрана, унитиол. Въпросът за прекъсване на бременността се решава индивидуално.
Доказана полза комплексно лечениехерпетични лезии. Основната химиотерапия е ацикловир или валацикловир. Химиотерапията е възможна от първия триместър на бременността. Въпреки липсата на доказателства за тератогенни и ембриотоксични ефекти, назначаването на ацикловир при бременни жени е ограничено поради следните индикации: първичен генитален херпес, рецидивиращ генитален херпес (типична форма), генитален херпес в комбинация със заплашен спонтанен аборт или симптоми на IUI. При бременни жени с чести рецидиви на инфекцията се провежда постоянно лечение с ацикловир (супресивна терапия). В случай на усложнен ход на херпесна инфекция (пневмония, енцефалит, хепатит, коагулопатия), лечението се провежда съвместно с инфекционист.
В същото време е препоръчително да се предпише имуноглобулинова терапия, интерферонови препарати, "големи" антиоксиданти (витамини Е и С). Трябва да се отбележи необходимостта от лечение на заболявания, свързани с херпес (най-често хламидия, микоплазмоза, трихомониаза, кандидоза, бактериална вагиноза). Както и за лечение на цитомегалия, плазмаферезата и ендоваскуларното лазерно облъчване на кръвта са намерили своето място в лечението на херпесната инфекция. След комплексна терапия честотата на усложненията за майката и плода намалява 2-3 пъти.
Акушерското лечение на жени с генитален херпес зависи от неговата форма и продължителността на бременността. В случай на първична инфекция по време на бременност (1 месец преди раждането или по-малко) или рецидив (няколко дни преди раждането) се провежда химиотерапия,
раждането се извършва чрез цезарово сечение. При наличие на анамнеза за генитален херпес при един от родителите е показано изследване на културата или PCR преди раждането. При отрицателен отговор - раждане през родовия канал.
Въпреки правилно организираната акушерска помощ, в момента няма условия за пълно елиминиране на предаването на HSV инфекцията от майка на новородено. Това се дължи на невъзможността да се идентифицират всички жени с асимптоматична генитална херпесна инфекция. В тази връзка в 70% от случаите на предаване на херпесна инфекция на новородени става именно от майки с асимптоматичен херпес.
рубеола
Ролята на вируса на рубеола като причина за вродени малформации е призната за първи път през 1941 г. от австралийския офталмолог Норман Грег. Той за първи път описва синдром на катаракта, глухота и вродено сърдечно заболяване при деца, чиито майки са имали рубеола по време на бременност по време на епидемията в Сидни през 1940 г. Вирусът е изолиран за първи път в тъканна култура през 1962 г. До 1969 г. се появява ефективна жива атенюирана ваксина
Вирусът на рубеола е РНК-съдържащ вирус и принадлежи към групата на тогавирусите (микровирусите). Човекът е единственият носител. Вирусът на рубеола не е устойчив на външна среда, се разпространява по въздушно-капков път; за заразяване е необходим дългосрочен контакт, обикновено един контакт не е достатъчен, но тъй като заболяването често протича безсимптомно, контактът може да не е известен.
По-голямата част от хората, които са имали рубеола, развиват стабилен имунитет, но 0,3-4,25% от хората отново се разболяват от рубеола, тъй като е възможно реактивиране на преди това прехвърлена рубеола или повторна инфекция в резултат на непълноценността на съществуващия хуморален имунитет. В същото време, според изследователи от Санкт Петербург, на практика такива наблюдения всъщност не се случват и ако острата рубеола се изключи клинично и серологично, тогава рискът от вътрематочна инфекция е изключен. Ако има висок или нарастващ титър на антитела срещу антигена на рубеола, е необходимо да се определят специфични IgM антитела в майката и ако се открият, в кръвта на плода, получена чрез кордоцентеза.
Инфекцията на плода става само от болна майка. На жените, които са били болни от рубеола, може да се препоръча бременност не по-рано от 6 месеца след възстановяването. Поражението възниква в резултат на виремия и трансплацентарно проникване на вируса.
Само клиничните симптоми не са достатъчни за поставяне на диагнозата. По същата причина анамнезата за рубеола не е показател за имунитет. За доказване на инфекция с рубеола е необходимо изолиране на вируса или подходящо серологично изследване.
Критериите за диагностициране на скорошна рубеола са:
Изолиране на вируса на рубеола (обикновено от гърлото);
Повишаване на титъра на антителата 4 пъти или повече;
Наличието на специфичен за рубеола IgM, който се определя само в рамките на 4-6 седмици след първичната инфекция.
Ако диагнозата остава под съмнение, особено ако контактът е възникнал в най-ранните етапи на бременността, може да се извърши амниоцентеза на 14-20 седмица и да се направи опит за изолиране на вируса на рубеола от амниотичната течност, което, ако е успешно, ще покаже поне инфекция на плацентата. Отрицателните резултати от културата не изключват инфекция на плацентата или плода. Най-точна е кордоцентезата.
Рубеола при бременна жена може да има следните резултати:
Няма ефект върху плода;
Инфекция само на плацентата;
Инфекция на плацентата и плода (от безсимптомно протичанепреди поражението на много системи);
Смърт на плода (спонтанно преждевременно прекъсване на бременността или мъртво раждане).
Инфекцията на плода може да последва инфекция на майката на всеки етап от бременността, като резултатът от рубеола силно зависи от гестационната възраст.
Вероятността от инфекция на плода преди 8 гестационна седмица е 54%, на 9-12 седмици - 34%, 13-24 седмици - 10-20% и не повече от 12% - от края на II триместър. Виремията при жена през първите 8 седмици от бременността води до инфекция на плацентата и спонтанен аборт или мъртво раждане; при заразяване в средата на бременността рубеоларната фетопатия се диагностицира по-често при недоносени новородени; с инфекция с рубеола през третия триместър
протича без вродени малформации като хроничен енцефалит и продуктивен лептоменингит при новородени.
Клиника на вродена рубеола.Вирусът на рубеола проявява изключителен тропизъм към млада ембрионална тъкан, което се свързва с ембриопатия при това заболяване. Плодът е засегнат от вируса на рубеола по много начини. Разпределете "класически вроден синдром на рубеола"която включва триада от най-типичните аномалии в развитието: катарактас помътняване на роговицата, сърдечни дефекти(вродени дефекти на камерната преграда - рубеоларна ембриопатия) и глухота(кръвоизливи в меки тъканивъншна, средна и вътрешно ухо). Синдромът на вродена рубеола често се комбинира с продуктивна интерстициална пневмония с гигантска клетъчна метаморфоза на алвеолоцитите.
В допълнение към класическия има „Напреднал синдром на вродена рубеола“която, освен трите изброени малформации, включва много други аномалии в развитието: микроцефалия, уголемена фонтанела, увреждане на мозъка, глаукома, цепнато небце, интерстициална пневмония, хепатит, увреждане на вестибуларния апарат, скелетни малформации, увреждане на тубуларни кости, хепатоспленомегалия, урогенитални малформации органи.
До 70% от оцелелите деца със серологични данни за инфекция при раждането са здрави, но през първите 5 години от живота повече от 2/3 от децата развиват признаци на инфекция. Най-често това са по-малко очевидни усложнения, които се състоят от лека до умерена глухота и увреждане на мозъка със забавено психомоторно развитие. Късните прояви на рубеола също включват имунологична дискразия (забавяне на способността на новороденото да синтезира собствени имуноглобулини в отговор на вирусна инфекция), загуба на слуха, психомоторна изостаналост, аутизъм, церебрални синдроми (склерозиращ паненцефалит), захарен диабет.
Сред неонаталните прояви на рубеола най-характерна е тромбоцитопеничната пурпура, която продължава от 2 седмици до 3 месеца. Типичен хепатит с жълтеница, хемолитична анемия с ретикулоцитоза и деформирани еритроцити, незакриване на предната фонтанела с плеоцитоза на цереброспиналната течност, интерстициална пневмония, лезии на тубуларни кости (открива се рентгенографски и се състои в редуващи се области на уплътняване и разреждане на костта). От сърдечните пороци най-често
е цепнатина на артериалния (Боталлов) канал, често в комбинация със стеноза белодробна артерия. Има също стеноза и коарктация на аортата, VSD и ASD, транспозиция на големи съдове; дефекти от "син" тип са редки.
Най-типичното очно заболяване - катаракта - е резултат от прякото действие на вируса на рубеола, който може да персистира в лещата няколко години. Катарактата може да липсва при раждането и да се появи в неонаталния период. Глаукомата се среща 10 пъти по-рядко. В допълнение, при рубеола може да се открие пигментна ретинопатия, замъгляване на роговицата, миопия и недоразвитие на клепачите.
Най-честият дефект при вродената рубеола е глухотата, често съчетана с вестибулопатия - дефект в кортиевия орган.
Колкото по-кратка е гестационната възраст, на която жените боледуват от рубеола, толкова по-често се проявява тератогенният ефект на вируса. Тератогенната опасност от рубеола през първия месец от бременността е 35-50% (според някои доклади се доближава до 100%), през 2-ия месец -
25%, в 3-та - 7-10%.
Неблагоприятният ефект на рубеолата върху плода се проявява не само чрез нейния тератогенен ефект. рубеолна инфекция в ранен периодбременността в 10-40% може да доведе до спонтанни аборти, в 20% - до мъртво раждане, 10-25% от децата, родени живи, умират в неонаталния период.
Заболяването от рубеола през първия триместър на бременността, потвърдено от клинични, епидемиологични и лабораторни данни, е индикация за нейното прекъсване. При контакт на бременна жена с болен от рубеола, не по-късно от 10-12 дни, е необходимо да се проведе серологично изследване. Ако серонегативната реакция продължи, внимателно наблюдение и повторно серологично изследване след 2 седмици за откриване на асимптоматична инфекция.
Профилактиката е предимно чрез имунизация. Необходима е ваксинация на децата. Бременните не се ваксинират, защото се използва отслабена ваксина. жива ваксинаи тератогенни ефекти не могат да бъдат изключени. Препоръчва се скрининг на жени в детеродна възраст за наличие на антитела срещу антигени на вируса на рубеола.
Токсоплазмоза
Toxoplasma gondiiпринадлежи към протозоите, които инфектират клетки от почти всеки тип при бозайниците. Този инфекциозен агент е широко разпространен в целия свят, засягайки хора и животни, но последният цикъл на размножаване се случва само в червата на котките. Ооцистите влизат в тялото на човек, който яде зеленчуци или други храни, заразени с ооцисти от почвата. След абсорбцията на ооцистите в червата се освобождават трофозоити. Те проникват в епитела, където се размножават и след това - чрез лимфната и кръвоносната система - се разпространяват в тялото. В тялото на здрав имунокомпетентен гостоприемник възпроизвеждането на трофозоити е ограничено от развитието на клетъчен имунен отговор и в по-малка степен от производството на специфични антитела. Някои от тези организми предотвратяват образуването на тъканни псевдокисти, които са интерстициаленнатрупвания на организми, заобиколени от защитна обвивка. В тази форма те остават латентни, но жизнеспособни през целия живот на гостоприемника, обикновено без да предизвикват значителен имунен отговор. Ако нормалният имунитет е намален по някаква причина, инфекцията може да се активира отново.
Друг важен път на заразяване е консумацията на сурово или недостатъчно топлинно месо от заразено животно. По този начин най-често човек се заразява при консумация на агнешко или свинско месо. От един човек на друг инфекцията не се предава, с изключение на предаването през плацентата от майката на плода по време на развитието остра инфекцияпо време на бременност. Няма убедителни данни за връзката на хронична или латентна инфекция с повтарящи се аборти.
Честота на инфекция при хора T. gondiiвъв всяка популация зависи от климата, начина на приготвяне на храната и в допълнение контакта с котки. Разпространението на откриваемите антитела е стабилно
Честотата на вродената токсоплазмоза е трудно да се определи, тъй като повечето заразени деца са практически здрави при раждането, а инфекцията при майката обикновено протича безсимптомно. Има данни, че повечето заразени деца впоследствие страдат от сериозни усложнениятази инфекция, която може да изисква специализирано дългосрочно лечение. Теоретично изчисленият риск от вродена инфекция, базиран на годишните нива на сероконверсия при жени в детеродна възраст, варира от 4 до 50 на 10 000 живородени.
Клинични прояви на инфекция.Клиничните прояви на инфекция при токсоплазмоза са както следва.
„Придобита токсоплазмоза.В повечето случаи човешка инфекция T. gondiiе безсимптомно или неразпознато. от най-много често проявлениеинфекцията е генерализирана лимфаденопатия, която, макар и не винаги, е свързана с неразположение, треска, болки в гърлото, главоболие, обрив. Понякога в същото време се открива атипична лимфоцитоза без хетерофилни антитела. Инфекцията обикновено е ограничена. В редки по-сериозни случаи мозъкът, миокардът, черният дроб или белите дробове са въвлечени в инфекциозния процес, което изисква специфично лечение. Хориоретинитът е относително рядък и обикновено е едностранен. * Вродена токсоплазмоза.Когато една жена е заразена с токсоплазмоза в самото начало на бременността, рискът от предаване на нейния плод е сравнително малък (около 20%), но инфекцията през този период може да има тежки последствиядо смъртта на плода. При раждането аномалиите се откриват само при 10-20% от децата с вродена токсоплазмоза, повечето деца с тежки нарушения се заразяват в ранна бременност. Тежката вътрематочна токсоплазмоза може да доведе до смърт или
сериозни аномалии в развитието на плода, включително хидроцефалия, образуване на кисти с калцификации или екстремно изтъняване на мозъчната кора с калцификации, глиални пролиферати, продуктивен ендартериит, развитие на генерализиран оток с хидроторакс и асцит, широко разпространено възпаление и разрушаване на тъканите на различни органи. В последващото раждане се разкрива хроничен вилузит, в стромата на вилите - лимфоидна инфилтрацияс примес на плазмени клетки. специфичен знаке откриването на патогена под формата на кисти или свободно лежащи форми при оцветяване според петна-отпечатъци от Romanovsky-Giemsa от майчината повърхност на плацентата или от дълбочината на разреза на плацентарната тъкан; окончателната диагноза се основава на откриването на протозои в интерстициалните псевдокисти на плода.
Тежка вродена токсоплазмозапри новородени често е генерализирано заболяване, проявяващо се като анемия, уголемяване на черния дроб и далака, жълтеница, треска и лимфаденопатия. При внимателно изследване на фундуса повечето заразени деца показват признаци на двустранен хориоретинит. Засягането на ЦНС може да се прояви като интракраниална калцификация, гърчове, хидроцефалия, микроцефалия или промени в цереброспиналната течност (особено напреднало нивокатерица). Приблизително 80% от децата с клинични признаци на токсоплазмоза при раждането имат необратими мозъчни увреждания и 50% имат зрителни увреждания. Когато майката се разболее от токсоплазмоза по-късно през бременността, има по-голяма вероятност за заразяване на плода, но при раждането клиничните признаци на инфекция в повечето случаи не се проявяват, а ако се проявят, те обикновено са локализирани в очна ябълкаили централната нервна система и при новороденото често остават незабелязани.
Очните симптоми постепенно се появяват при повече от 80% от заразените деца, въпреки че понякога се разпознават само при по-големи деца или юноши. Приблизително 4 деца в тази група страдат от значителна зрителна загуба и същия брой от рецидивиращ активен хориоретинит с поне временно зрително увреждане.
сериозно неврологични разстройствапо-рядко (<10%), в отдаленном периоде прицельное изучение умственных способ-
Резултатите показват влошаване на резултатите при повече деца. Често има частична загуба на слуха.
Профилактика и лечение на бременни жени с токсоплазмоза.Рискът от заразяване с токсоплазмоза може да бъде намален по следните начини.
1. Избягвайте да ядете недостатъчно топлинно или сурово месо, особено свинско или агнешко, и измивайте ръцете си старателно след работа със сурово месо.
2. Не е необходимо да избягвате контакт с домашна котка по време на бременност, въпреки че е по-добре да не започвате ново животно по това време. Котешкият пясък трябва да се сменя по-често и за предпочитане от някой друг. Трябва да се храни само с варено или консервирано месо.
3. Необходимо е пресните зеленчуци да се измиват добре преди консумация, за да не попадне замърсена пръст в храната.
4. Измийте добре ръцете си след работа в градината, особено преди хранене.
Между острата токсоплазмоза при бременна жена и началото на инфекциозен процес в плода минава значително време. Ако инфекцията се развие през първата половина на бременността, може да се повдигне въпросът за изкуствен аборт, тъй като рискът от предаването й на плода в ранните етапи достига 20%, а последствията са опустошителни. В късните етапи на бременността бременната жена се лекува с пириметамин, сулфонамиди, тиндурин. Успешно се използва макролидният антибиотик спиромицин.
Хламидия
Хламидиите се предават най-често по полов път и засягат предимно клетките на цилиндричния епител. Също така е доказано
възможността за разпространение на хламидия по „домашен“ начин, главно сред малки деца.
Клинични прояви на хламидия.Въвеждането на хламидия в пикочно-половия тракт не винаги е придружено от забележими клинични прояви. Заболяването често е субманифестно или безсимптомно. Половината от заразените жени са без клинични прояви. Хламидийният уретрит няма специфични прояви, пациентите рядко се оплакват от дизурия. Понякога хламидиите могат да причинят ексудативно възпаление на каналите и бартолиновите жлези. Цервицитът се наблюдава като първична и най-честа проява на хламидийната активност. Секрецията от цервикалния канал мацерира многослойния плосък епител на вагиналната част на шийката на матката, причинявайки частичната му десквамация. Шийката на матката става едематозна, хиперемирана, образува се така наречената хипертрофична ектопия на шийката на матката. Хламидиалният салпингит е най-честата проява на асцендентна хламидиална инфекция. Характеристика на хламидиалния салпингит и салпингоофорит е техният дълъг, подостър, изтрит курс без тенденция към "тегло". Хроничната инфекция може да причини запушване на тръбите, извънматочна бременност и безплодие. Жените с възходяща хламидийна инфекция с тазова възпалителна болест могат да развият перихепатит, синдром на Fitz-Hugh-Ciirtis. Този синдром се характеризира с висока температура, болка в черния дроб и тазовите органи.
В допълнение към урогениталната хламидия е възможна и екстрагенитална хламидийна инфекция (офталмохламидия), докато 72% от пациентите с офталмохламидия имат едновременно хламидийна инфекция на урогениталния тракт.
Урогениталната хламидия се диагностицира при бременни жени в 3-12%, достигайки 33-74% при хронични възпалителни заболявания на половите органи, хронични неспецифични белодробни заболявания, утежнена акушерска анамнеза (мъртво раждане, вътрематочна пневмония при новородено, преждевременно раждане, обичаен спонтанен аборт) .
Бременността с хламидия по правило протича с усложнения. През първия триместър са типични заплахата от прекъсване на бременността, неразвиваща се бременност, спонтанни аборти. Честотата на спонтанните аборти е 25%, перинаталните загуби при преждевременно раждане - до 5,5%.
Хламидията води не само до обичайни спонтанни аборти, но и до вътрематочна инфекция на плода и новороденото. Хламидиите колонизират главно конюнктивата, назофаринкса, дихателните пътища, червата, но най-характерно е увреждането на менингите и мозъчното вещество, където макроскопски се определят памучни отлагания, главно върху горните странични повърхности на полукълбата. Хистологично изглеждат като грануломи. Резултатът от хламидийната инфекция е повишаване на антенаталната смъртност, появата на трахомоподобен конюнктивит и пневмония при новородени. Когато амниотичната мембрана се зарази, се развива полихидрамнион, специфична лезия на плацентата води до развитие на фетоплацентарна недостатъчност (27%), sdfd и фетална хипоксия. Перинаталната смъртност при хламидия достига 15,5%, а делът на новородените, починали в постнаталния период, е повече от половината от всички перинатални загуби.
Клинични проявления.При 17-30% от бременните жени хламидията протича латентно или с незначителни симптоми. При наличие на смесена инфекция може да бъде с пълен симптомокомплекс, включително цервицит с цервикална ектопия.
Хламидията при бременни жени обикновено се комбинира с бактериална и вирусна инфекция, така че инфекцията на плода често възниква поради комбинирания ефект на тези патогени. Това обуславя полиморфизма на клиничните прояви на инфекцията при новороденото, следователно, наред с типичните прояви на хламидиална инфекция (конюнктивит, вулвовагинит, пневмония), има форми, които не са характерни за хламидиите (везикулопустулоза, омфалит, ринит, сепсис) .
Клиничните прояви на вътрематочни инфекциозни заболявания при новородени от майки с хламидия се разделят на три групи: леки форми, тежки форми и така нареченият синдром на инфекция.
Малките форми включват:
конюнктивит;
Вулвовагинит;
Везикулопустулоза, ринит, отит, омфалит - със смесена инфекция.
Тежки форми на вътрематочна инфекция при новородено с хламидиална инфекция:
Хламидиална пневмония;
Генерализиран възпалителен процес с развитие на сепсис и наличие на няколко огнища на инфекция (пневмония, флебит на пъпната вена, менингит, хепатит) - със смесена инфекция.
При синдрома на инфекцията липсват локални и генерализирани прояви на вътрематочна инфекция. Има нарушения на процесите на адаптация при новородени, промяна в цвета на кожата, намален мускулен тонус, нестабилност на рефлексите, продължителна жълтеница, първоначална загуба на тегло от 10% или повече, бавно възстановяване с многократно падане.
Профилактика и лечение на хламидия по време на бременност.Лечението на хламидия по време на бременност има определени трудности, което е свързано с особеностите на хода на заболяването, съпътстващата дисфункция на плацентарната система, възможността за неблагоприятни ефекти върху плода от традиционните схеми на лечение.
Антибактериална терапиясе провежда с лекарства от групата на макролидите: йозамицин, азитромицин. В случай на индивидуална непоносимост към горните лекарства е приемливо използването на цефалоспорини от III поколение.
локална терапия.При 95% от пациентите с хламидиална инфекция се наблюдават дисбиотични нарушения на микробиоценозата с различна тежест, придружени от повишаване на рН на вагиналното съдържание до 5,9. В допълнение, пациентите с урогенитална хламидия често имат значително замърсяване с дрождеви гъбички от рода Кандида.Тези резултати показват необходимостта от комбинирано използване на антибиотици, еубиотици и антимикотични лекарства. Местната терапия включва саниране на влагалището, последвано от назначаване на еубиотици орално и локално.
Имуномодулатори и интерферонови коректори.Характерна особеност на хламидийната инфекция е промяна във функционалната активност на имунната система, има отклонения в нивото на циркулиращите имунни комплекси, инхибиране на клетъчния имунитет, намаляване на фагоцитната активност на кръвните полинуклеарни клетки и макрофаги, инхибиране на активността на неспецифичните защитни фактори на тялото. За да се предотвратят имунни нарушения, свързани с хламидия, се предписват препарати от лактофлора (bifidobacteria bifidum, сушени лактобацили,
floradophilus), които не само коригират микробиоценозата на стомашно-чревния тракт, но чрез стимулиране на тимус-зависимите зони на мезентериалните лимфни възли активират имунния отговор. Растителните адаптогени имат имуномодулиращи свойства, които повишават общата неспецифична устойчивост на организма към инфекции. Лекарството на рекомбинантния интерферон се използва с висока ефективност.
Профилактика на дисфункции на фетоплацентарния комплекс.За подобряване на маточно-плацентарния кръвен поток се използват вазоактивни лекарства и антиагреганти. Като метаболитна терапия се предписва диета с високо съдържание на протеини, ферментирали млечни продукти с едновременна употреба на ензимни препарати. Токоферол ацетат (витамин Е), хепатопротективни агенти се използват като лекарства, които активират метаболизма.
Сифилис
Вроденият сифилис се развива в резултат на трансплацентарно разпространение Treponema pallidumот майката към плода. При пресни форми на инфекция при майката рискът от инфекция на плода е сравнително висок в сравнение с риска от инфекция в късния стадий на заболяването. Почти всички деца, чиито майки страдат от ранен стадий на нелекуван сифилис по време на бременност, са заразени и смъртността е много висока. Преди се смяташе, че T. pallidumзапочва да преминава през плацентата след 18-20 седмица от бременността, когато слоят от Лангерхансови клетки изчезва. Сега е доказано, че трансплацентарната инфекция на плода може да настъпи по-рано, но поради имунологичната незрялост на плода няма типична реакция към инфекция. Използването на подходящи методи за оцветяване открива спирохети в ембриони по време на аборт през първия триместър.
Инфекцията в ранния фетален период завършва с мъртво раждане с мацерация и воднянка на плода. Обикновено спонтанният аборт има характерен вид: колабиран череп, изпъкнал корем, хепатоспленомегалия, везикуларни кожни лезии, sdfd. Хистологично характерна ареактивна некроза в органи с натрупване на спирохети под формата на гнезда или гломерули в центровете на некротични огнища. Пролиферативните промени не са типични. В плацентата преобладава фокален вилузит с характерен ендартериит според вида на външния вид.
терационна ангиопатия, както и различни видове незрялост на вилизовото дърво.
Клинични проявления.Вроденият сифилис е мултисистемно заболяване, което варира значително по тежест и разнообразие от форми. Развива се при 50% от новородените, родени от майки с първичен или вторичен нелекуван сифилис по време на бременност (останалите 50% са мъртвородени, много недоносени и починали в ранния неонатален период). Проявите му наподобяват вторичен сифилис.
Прояви на вроден сифилис
1. Спонтанен аборт или мъртво раждане: мацериран плод, колабиран череп, изпъкнал корем, хепатоспленомегалия, хидропс феталис, везикулозни кожни прояви.
2. Водянка на плода.
3. Патологично разширена плацента (детето може да е нормално, явно инфектирано или мъртвородено).
4. Преждевременно раждане.
6. Кожно-лигавични прояви: персистиращ ринит, макулопапулозен, люспест или булозен обрив, обикновено по дланите и ходилата.
7. Хепатоспленомегалия, лимфаденопатия.
8. Анемия, тромбоцитопения
9. Жълтеница (хепатит и/или хемолиза).
10. Костни лезии: симетричен остеохондрит, периостит, остеомиелит на дълги кости, череп, гръбначен стълб и ребра. Типична рентгенова снимка, псевдопарализа може да се развие по-късно.
11. Увреждане на централната нервна система, обикновено безсимптомно. Увреждането се показва от промени в цереброспиналната течност.
Повечето живородени деца изглеждат здрави, някои имат везикуларни булозни лезии по дланите и стъпалата, но следните симптоми могат да се появят 4 дни след раждането:
1) грипоподобен синдром:
менингеални симптоми;
Сълзене (възпаление на ириса);
Изпускане от носа; лигавиците са хиперемични, едематозни, ерозирани;
Ангина (има папули по лигавицата на фаринкса);
Генерализирана артралгия (поради болка, липсват активни движения в крайниците - псевдопарализа на Parro; на рентгенови лъчи - феноменът на остеохондрит, често се отбелязва периостит, по-специално тибията (саблевидни крака);
2) увеличение на всички групи лимфни възли:
Шийни, лакътни, ингвинални, аксиларни, подколенни;
Хепатоспленомегалия (в тежки случаи - анемия, пурпура, жълтеница, оток, хипоалбуминемия);
3) обриви:
макулопапулозен;
Сливане на папулозни лезии с образуване на широки кондиломи.
Предотвратяване.Предотвратяването на вродения сифилис се свежда до скрининг преглед на бременни жени с цел навременно идентифициране на пациентите. При диагностициране през първия триместър на бременността е показано нейното прекъсване с оглед на факта, че инфекцията в ранните етапи на бременността води до образуване на тежки лезии в плода. Ако се открие сифилис в края на бременността, лечението се извършва съгласно препоръките на Министерството на здравеопазването на Руската федерация, съгласно общоприетите схеми, в зависимост от стадия на хода на заболяването.
Ако се подозира или потвърди вроден сифилис, новороденото трябва да бъде изолирано до започване на специфична терапия и още 24 часа от нейното започване.
Лечение.Специфична терапия се провежда при новородени в следните клинични ситуации:
Ако лечението на майката е било неадекватно;
Ако е извършено през последните 4 седмици от бременността;
Ако нищо не се знае за него;
Ако за лечение са използвани лекарства, различни от пеницилин.
Освен това се вземат предвид резултатите от реагин тестовете. По-високият титър на антителата от този на майката показва активен инфекциозен процес. Титърът на антителата трябва да се следи във времето, тъй като може да показва само трансплацентарно прехвърляне на майчини антитела към плода. Ако титърът на антителата намалява през първите 8 месеца от живота, тогава новороденото не го прави
заразен. При положителен резултат от теста лечението се провежда в тези наблюдения, когато не е възможно да се контролират титрите на антителата във времето.
Лекарството на избор за лечение на вроден сифилис е пеницилин G (прокаинпеницилин, бензатинпеницилин). Дневната доза на лекарството се изчислява в зависимост от телесното тегло на новороденото и неговата възраст.
Проследяването на ефективността на лечението се извършва според резултатите от количествените нетрепонемни тестове, които се провеждат на възраст 3, 6 и 12 месеца. Отрицателният резултат от теста показва ефективността на лечението. Запазването и повишаването на титъра на антителата изисква допълнително изследване и повторно лечение.
Вирусен хепатит
Острият вирусен хепатит може да бъде причинен от поне пет различни агента, но инфекциите на черния дроб, причинени от вируса на Epstein-Barr, цитомегаловируса и вируса на жълтата треска, се считат за отделни заболявания и обикновено не се подразбират, когато се използва терминът "остър вирусен хепатит".
Разпределете:
Вирусен хепатит А;
Вирусен хепатит В;
Вирусен хепатит, нито А, нито В (спорадичен и епидемичен), включително хепатит С (HCV);
Вирусен хепатит D (едновременна инфекция с хепатит B - коинфекция и последователна инфекция с хепатит B - суперинфекция).
Вирусът на хепатит А (HAV) принадлежи към рода ентеровируси от семейството на пикорновирусите. Вирусът, съдържащ РНК, се състои от вирион без обвивка.
Вирусът на хепатит B (HBV) е най-изследваният. Принадлежи към хепадновирусите и има по-сложна структура от вируса на хепатит А. Инфекциозната частица се състои от ядро (кора) и външна обвивка (капсид). Съставът на вириона включва кръгова двойноверижна ДНК и ДНК полимераза; репликацията на вирусни частици се случва в ядрата на заразените хепатоцити.
Най-малко четири различни системи антиген-антитяло са свързани с вируса на хепатит B.
1. Повърхностният AG (HBsAg, австралийски AG) е свързан с протеиновата обвивка на вируса. Откриването му в кръвната плазма дава възможност за диагностициране на остър хепатит В и означава, че кръвта на пациента е станала потенциален източник на инфекция. HBsAg се открива по време на инкубационния период (1-6 седмици преди развитието на клиничните и биохимичните признаци на заболяването) и изчезва след възстановяване. Могат да бъдат открити съответните антитела (anti-HBs), което означава, че по-късно, седмици или месеци след клинично възстановяване, тяхното присъствие показва минала инфекция и относителна защита в бъдеще. При 10% HBsAg продължава да се открива след острата фаза и съответните антитела не се появяват - такива пациенти обикновено развиват хроничен хепатит или стават асимптоматични носители на вируса.
2. Core AG (HBcAg) се свързва с ядрото (ядрото) на вириона. Може да се открие в инфектирани чернодробни клетки, а в плазмата се открива само ако вирусните частици се унищожат със специални техники. Съответните антитела (anti-HBc) обикновено се откриват в началото на периода на изява; впоследствие титърът им постепенно намалява. Наличието на AT-HBc, заедно с AT-HBs, показва предишна инфекция.
3. Антиген e (HBeAg), очевидно, е пептид, който е част от вирусното ядро. Открива се само в HBsAg-положителна плазма. Наличието показва активна репликация на вируса и се комбинира с повишена инфекциозна способност на кръвта и вероятност от развитие на хронично чернодробно увреждане.
Вирусът на хепатит D (HDV, делта фактор) е уникален. Неговата РНК е дефектна, в резултат на което този вирус може да се репликира само в присъствието на HBV. Хепатит D възниква или като съпътстваща инфекция при остър хепатит B, или като суперинфекция при значително хроничен хепатит B. Инфектираните хепатоцити съдържат делта частици, покрити с HBsAg. Клинично инфекцията се проявява с необичайно тежко протичане на остър хепатит В.
Терминът non-A non-B хепатит (NANB) е предложен да се отнася до инфекции, които не са свързани с A- и B-тип вируси. Сравнително наскоро беше идентифициран специфичен едноверижен РНК вирус, подобен на флавивирусите (вирус на хепатит С), който е
причинява повечето посттрансфузионни и спорадични случаи на NANB хепатит. Характеристика на HCV е изключително високата хетерогенност на неговия геном. Идентифицирани са поне шест основни генотипа на вируса. Анти-HCV антителата често се появяват в плазмата няколко месеца след остра инфекция. След това титрите постепенно намаляват, освен ако инфекцията не стане хронична (какъвто е случаят в 50%). HCV вирусът се идентифицира в плазмата чрез сложна техника, съответният антиген се изолира от хепатоцитите.
Вирус хепатит Аразпространява се главно по фекално-орален път, възможна е инфекция и чрез кръвта и екскреционните продукти. Източникът на инфекция е само пациент в ранен стадий на заболяването - вирусоносителите и хроничните форми на инфекция са изключени. Продромалният (предиктеричен) стадий се характеризира с остра треска, втрисане, главоболие и диспептични разстройства. На този етап често се отбелязва сърбеж, който е придружен от увеличаване на размера на черния дроб, повишаване на нивото на трансферазите в кръвта 5-7 дни преди появата на жълтеница. Често инфекцията протича безсимптомно.
Вирус хепатит Бобикновено се предава парентерално: чрез заразена кръв и нейните производни. Възможна инфекция по време на татуиране. Предаването остава високо сред наркозависимите и рискът е повишен за пациенти на хемодиализа и болничен персонал, които влизат в контакт с кръв. Има непарентерално сексуално разпространение. Хроничните носители на HBV служат като резервоар на инфекцията.
HBV инфекцията е придружена от широк спектър от чернодробни лезии, от субклинично носителство до остър и хроничен хепатит, цироза и хепатоцелуларен карцином. След дълъг инкубационен период (6 седмици до 6 месеца) се появяват признаци на остра инфекция. Преиктеричният период, за разлика от хепатит А, продължава по-дълго и се характеризира с постепенно начало с артралгия, уртикариален обрив, диспептични и астенични разстройства и нараства хепатолиенален синдром. При тежки форми на заболяването температурата се повишава. В кръвта - повишени нива на трансаминазите; HBsAg, HBeAg и
С появата на жълтеница, интоксикация, диспептични, астенични прояви се увеличават и още повече - хепатолиенален синдром.
Протичането на жълтеницата е по-изразено. В тежки случаи може да се развие хеморагичен синдром, остра чернодробна енцефалопатия с преход към кома и дори смърт.
При бременни пациенти с хепатит В има висока честота на преждевременно раждане и прееклампсия. Повече от 50% от жените имат възпалителни промени в следродилния период.
Хепатит, нито Ani B(NANB) има вариант, подобен на хепатит А, който се разпространява предимно чрез водни огнища. Вариант, близък до хепатит В, обикновено с по-кратък инкубационен период, често води до образуване на хроничен хепатит.
И накрая, има смесени варианти на инфекция (A и B, B и D, B и CMV, B и HIV).
Средната продължителност на инкубационния период при инфекция с хепатит А е 2-6 седмици, хепатит В - 6-25 седмици, нито А, нито В - 2-25 седмици. Децата и младите хора са по-често засегнати, но заболяването може да се появи на всяка възраст.
Вирусният хепатит е най-честата причина за жълтеница по време на бременност. Обикновено протича сравнително лесно, но при недохранване може да възникне тежка епидемична форма на хепатит, нито А, нито В. Майчината смъртност е 0,64-1,79%, но може да достигне 15,6% (Farber N.A. et al., 1990). Хепатитът протича по-тежко през втората половина на бременността, което е свързано с промени в хормоналните нива, по-изразени симптоми на холестаза
Вроденият вирусен хепатит се среща рядко, с остър или хроничен хепатит В на майката по време на бременност; Също така майка с асимптоматична форма на хепатит (носител на антиген) може да бъде източник на вътрематочна инфекция. Феталният хепатит се характеризира с полиморфизъм на хепатоцитите с образуването на многоядрени симпластни клетки, както и холестаза (вътреклетъчна и интратубуларна), образуване на аденоматозни структури и билиарна некроза с лоша лимфоцитна инфилтрация на порталните пътища. Тежкият хепатит при майката може да доведе до антенатална смърт на плода. Макроскопски, в последващото раждане, се забелязва жълтеникав цвят на мембраните, феталната повърхност на плацентата, хистологично - при спонтанни аборти, множество клетки на Кащенко-Хофбауер се записват в стромата на вилите на плацентата и мембраните, които абсорбират билирубин, с минимални възпалителни промени.
Няма убедителни данни за тератогенността на хепатита през първия триместър на бременността. Вирусът на хепатит В може да бъде предаден на новороденото при раждането или, по-рядко, през плацентата. През I и II триместър на бременността остър хепатит В рядко се предава на плода (5%). Предаването през плацентата не е окончателно установено и най-вероятно е при положителни за е-антиген майки, които са хронични носители на повърхностна хипертония на хепатит В (HBsAg) или са развили хепатит през третия триместър. При заболяване в III триместър вероятността от инфекция на плода е 60-70%. Най-често инфекцията възниква по време на раждане поради микропреливане на кръв от майката на плода или в резултат на контакт на детето със заразени секрети на майката при преминаване през родовия канал. Положителният HBeAg тест (отразяващ висока степен на инфекция) е свързан с 80-90% шанс за предаване на плода. Повече от 85% от новородените от такива майки стават хронични носители. Ако майката има антитела срещу HBeAg (наличието им показва отзвучаване на инфекцията), рискът от инфекция е само 25%. Възможна инфекция в постнаталния период (с мляко, слюнка)
Инфектираните новородени често стават носители на HBV и имат субклинично чернодробно увреждане. Наблюденията за явен неонатален хепатит са редки.
Прогноза.Хепатит А обикновено преминава спонтанно за 4 до 8 седмици – в повечето случаи не изисква специално лечение. Не се изисква ограничаване на диетата и физическата активност. Честотата на спонтанните аборти не надвишава тази в популацията. Плодът практически не е изложен на риск от инфекция и новороденото не се нуждае от профилактика.
При хепатит В прогнозата е по-малко благоприятна, отколкото при А. Особено след кръвопреливане, когато смъртността може да достигне 10-15%; в 5-10% се образува хронична форма. Смъртността при бременните е 3 пъти по-висока от тази при небременните. Честотата на хепатит при новородени е 45-62%.
Най-голямата опасност за бременните жени е епидемичният вариант на NANB хепатит през II и III триместър на бременността. Усложнения: спонтанни аборти, преждевременни раждания, висока майчина смъртност, неонатална заболеваемост и перинатална смъртност.
Профилактика и лечение на инфекции.Личната хигиена помага за предотвратяване на хепатит А. Ако бременна жена влезе в контакт с болен човек в продължение на 7-10 дни, стандартен γ -глобулин 1,5-3,0 мл еднократно мускулно. На по-късна дата употребата на лекарството е непрактична.
За предотвратяване на хепатит В трябва да се въведат ограничения за кръвопреливане, да се въведе използването на HBsAg-тествана кръв. Необходим е скрининг на донора за HCVAg. Стандартният имуноглобулин осигурява защита срещу клинична HAV инфекция и се дава на тези, които имат битови контакти с установен носител.
Ваксинирането срещу HBV води до производството на антитела при здрави реципиенти и намалява разпространението на хепатита с 90%. Пациентите на диализа, с цироза на черния дроб и други имунни нарушения реагират по-зле на ваксинацията. Малка част от здравите хора не реагират с образуването на AT-HBs.
Изследването на бременни жени за носителство на HBsAg трябва да се извърши още в ранна бременност.
При хепатит С ролята на перинаталната инфекция в разпространението на тази инфекция не е напълно определена. Откриването на РНК на вируса на хепатит С в кръвните серуми на деца на 1-5-ия ден след раждането дава основание да се предположи, че и при тази инфекция има пренатална инфекция. Лечението на хепатит С се основава на интерферонова терапия (интерферон, индуктори на интерферон), както и употребата на антивирусни лекарства.
При лек и умерен хепатит (всеки) през първия триместър на бременността бременността може да продължи, тъй като до момента на раждането жената ще бъде здрава и вероятността от вродени аномалии при нейното дете не е по-висока, отколкото при здраво. При тежък хепатит след възстановяване, в зависимост от характеристиките на хода на инфекцията и продължителността на бременността, се препоръчва прекъсването й: до 12 седмици - медицински аборт, след 12 седмици - интраамниално приложение на хипертоничен разтвор на натриев хлорид, простагландин F2a ; интрамускулно с въвеждането на простагландин след предварително (12 часа) разширяване на шийката на матката със средно големи водорасли.
При лечение, физическа почивка, балансирано пиене, лечение на заплахата от преждевременно прекъсване на бременността и, ако е възможно, изместване на времето на физиологичното раждане, което в разгара на жълтеницата носи не само нежелано физическо натоварване, но и внезапни хормонални промените, които могат да изведат тялото от компенсиран относителен баланс, са важни. Показана предпазлива инфузионна детоксикационна терапия под контрола на диурезата. При задържане на течности се използват диуретици. Кратък курс на глюкокортикоиди - като неразделна част от комплекс от мерки за дехидратация при развиващ се церебрален оток. Назначаването на кортикостероидна терапия е непрактично и дори може да допринесе за развитието на хепатоцитодистрофия.
Децата, родени от HBsAg-позитивна майка, независимо дали тя има серумен HBe антиген или антитела, трябва да получат профилактично лечение веднага след раждането с имуноглобулин срещу хепатит B (HBIg), след което трябва да получат три ваксинации с рекомбинантна ваксина срещу вируса на хепатит C. Изолиране на новородени от майки и не се препоръчва отказ от кърмене, особено след въвеждането на HBIg и антивирусна ваксина. Ако HBsAg се екскретира в кърмата, за да се предотврати инфекция по време на неонаталния период, кърменето не е показано.
Лечението на новородени с остър хепатит В е симптоматично с адекватно хранене; нито стероидите, нито HBIg са ефективни. Необходимо е да се изолира заразеното новородено и да се работи изключително внимателно при работа с кръвта и лайна му.
ПОДГОТОВКА ЗА БРЕМЕННОСТ И ВОДЕНЕ НА БРЕМЕННОСТТА
По този начин вътрематочните инфекции представляват сериозна заплаха за живота и здравето на плода и новороденото и често имат неблагоприятни дългосрочни последици. Диагностиката и лечението на инфекциозни заболявания при бременни жени представляват значителни трудности поради замъгляването, разнообразието и неспецифичността на клиничните прояви, трудностите при получаване на материал за лабораторни изследвания и невъзможността за широко използване на терапевтични лекарства.
Във връзка с гореизложеното, методите за превенция на IUI, базирани на превенция и лечение на инфекция при майката, са от особено значение. Най-перспективна в тази насока е предгравидната подготовка на брачните двойки, последвана от последователно прилагане на терапевтични и диагностични мерки по време на бременност.
Прегравидната подготовка трябва да включва:
Идентифициране на рискова група въз основа на анамнеза и резултати от клиничен преглед, идентифициране на съпътстващи екстрагенитални заболявания;
Цялостен преглед с изследване на имунния, хормонален, микробиологичен статус;
Етиотропна антибактериална или антивирусна терапия;
Провеждане на подходяща корекция на идентифицираните нарушения на микроценозата на гениталния тракт, последвано от назначаване на еубиотици;
Лечение на заболявания с използване на имуностимулираща и интерферон-коригираща терапия, както и физиотерапия;
метаболитна терапия;
Корекция на менструални нередности и свързаните с тях ендокринопатии;
Лечение на сексуалния партньор при наличие на полово предавани болести.
По време на бременност на срокове до 12, както и на 18-20, 28-30 и 37-38 седмици при бременни жени от тази група е показана оценка на състоянието на вагиналната микроценоза до 12 седмици (по-нататък според индикации на 18-20 и 37-38 седмици) - идентифициране на патогени на полово предавани болести и определяне на титъра на специфични Ig към вирусни и бактериални агенти. Ако се открият инфекции, се провежда подходящо лечение, което се избира, като се вземе предвид продължителността на бременността и възможния ефект на лекарствата върху развитието на плода.
Редовното ехографско, доплерово и кардиотокографско изследване позволява своевременно диагностициране на развиваща се фетоплацентарна недостатъчност, лечение и проследяване на неговата ефективност.
Провеждане на предгравидна подготовка и мерки за идентифициране на застрашени вътрематочни инфекции
позволява да се намали честотата на вътрематочните инфекции с 2,4 пъти. В същото време броят на усложненията на бременността и раждането (особено преждевременното прекъсване на бременността, както и фетоплацентарната недостатъчност) намалява, което спомага за намаляване на общата честота на новородените с 1,5 пъти.
Вътрематочната инфекция може да има различни прояви в зависимост от това колко дълго е настъпила инфекцията на плода.
- 3-12-та седмица от бременността: прекъсване на бременността (спонтанен аборт) или образуване на малформации на плода (отклонения от нормалната структура на тялото, възникващи по време на вътрематочно или по-рядко следродилно развитие);
- 11-28 седмица от бременността: възниква вътрематочно забавяне на растежа, бебето се ражда с ниско телесно тегло, малформации на плода (например отклонения в развитието на сърцето (неправилно образуване на прегради и др.)).
- 10-40 седмици от бременността: фетопатия (заболявания на плода; образува се увреждане на органите на плода, например фетална пневмония (пневмония в плода).
Ако не е имало спонтанен аборт (спонтанен аборт) и детето е родено с инфекция в пренаталния период, такива деца имат (в различна степен на тежест и в една или друга комбинация) следните признаци:
- вътрематочно забавяне на растежа;
- хепатоспленомегалия (уголемяване на черния дроб и далака);
- ранна жълтеница;
- обрив от различен характер;
- нарушения на дихателната функция;
- сърдечно-съдова недостатъчност;
- неврологични разстройства;
- висока телесна температура през първия ден от живота;
- възпалителни (напр. конюнктивит) и дегенеративни (напр. атрофия на зрителния нерв) очни заболявания.
Такива деца се раждат без признаци на нарушения, но след известно време (не по-късно от третия ден от живота) се появяват:
- летаргия;
- бледост;
- загуба на апетит;
- повишена регургитация;
- дихателна недостатъчност;
- увреждане на всеки орган (с инфекция по време на раждане, възпалението се отбелязва по-често от един орган, например бели дробове, черен дроб и др.).
Причините
- Инфекцията на плода идва от болна майка.
- Механизми на инфекция:
- трансплацентарен (хематогенен) път - патогенът от майката навлиза в плода през плацентата (по този начин често се предават вируси и токсоплазма);
- възходящ път - пътят на инфекция, при който инфекцията от гениталния тракт навлиза в маточната кухина и след това може да зарази плода (типично за хламидиална инфекция, ентерококи);
- низходящ път - патогенът от фалопиевите тръби се въвежда в маточната кухина и след това в тялото на плода;
- контактен (интранатален) път - инфекцията на плода възниква по време на преминаване през родовия канал, например при поглъщане на заразена амниотична течност, когато патогенът от заразената амниотична течност навлезе в лигавиците и очите.
- Фактори, допринасящи за развитието на вътрематочна инфекция на плода:
- заболявания на пикочно-половата система при майката (цервикална ерозия, инфекция под формата на уретрит (възпаление на уретрата), цистит (възпаление на пикочния мехур), пиелонефрит (възпалително заболяване на бъбреците) и др.);
- инфекции, пренесени по време на бременност, дори SARS (остра респираторна вирусна инфекция);
- състояния на имунна недостатъчност, включително HIV инфекция;
- състояния след трансплантация на органи и тъкани.
Диагностика
- Диагнозата на вътрематочната инфекция по време на бременност е трудна, тъй като вътрематочната инфекция на плода не е придружена от никакви специфични прояви при майката.
- На етапа на планиране на бременността болестите, предавани по полов път, и най-честите урогенитални инфекции се диагностицират чрез PCR (полимеразна верижна реакция). По време на бременност се извършва и диагностика за наличието на тези заболявания, тъй като имунитетът на бременната жена е физиологично намален, съответно се увеличава чувствителността към различни инфекциозни заболявания.
- Диагностика на кръвта на бременна жена за TORCH инфекция, ХИВ, сифилис (венерическо заболяване, засягащо кожата, лигавиците, вътрешните органи, костите, нервната система), хепатит B и C чрез изследване на кръвта за наличие на антитела (защитни тела) към причинителите на тези инфекции.
- Съставът и количеството на защитните тела (имуноглобулини) M и G също могат да се използват за преценка на риска от вътрематочна инфекция на плода:
- откриването на специфичен IgG в малко количество показва, че инфекцията е била в миналото, имунитетът е формиран към този патоген и болестта не представлява опасност нито за майката, нито за детето;
- повишаването на съдържанието на IgG или появата на IgM показва повторна поява на инфекцията. Вероятността от вътрематочна инфекция е относително ниска;
- в разгара на инфекцията при жена, която преди това не е била болна от едно или друго заболяване, се открива само IgM. При някои инфекции (например при херпесвирусна инфекция или цитомегаловирус) рискът от инфекция на плода по време на първоначалната инфекция на бременна жена е около половината от случаите.
- Ултразвуково изследване за диагностициране на функцията на плацентата, кръвообращението на плода (промени в структурата на плацентата, например нейното удебеляване, повишено или намалено съдържание на амниотична течност, наличие на суспензия в околоплодната течност може да показва наличието на вътрематочна инфекция на плода).
- В някои случаи се предписва биопсия на хорион (вземане на част от външната обвивка на ембриона за целите на неговото изследване), последвано от амниоцентеза (вземане на проби от околоплодна течност), кордоцентеза (изследване на кръвта от пъпната връв на плода). чрез бактериологично изследване (засяване върху хранителна среда с допълнителна оценка на отглежданите колонии) за наличие на патоген.
- Изследване на плацентата (плацента, мембрани и пъпна връв) чрез бактериологични и имунохистохимични методи (метод за микроскопско изследване на тъкани за наличие на определен патоген).
- Серологични изследвания на кръвта на новородено чрез ензимен имуноанализ (ELISA) за определяне на антитела IgM, IgG, IgA (IgG в кръвта на дете може да показва въвеждането на майчини антитела, така че кръвта на новородено се изследва отново след 3- 4 седмици; увеличението на съдържанието на IgG с 4 пъти или повече показва възможен инфекциозен процес. IgM в кръвта на новородено показва наличието на активна инфекция при детето).
- Децата със съмнение за вътрематочна инфекция се предписват ултразвук на коремната кухина за откриване на увеличен черен дроб и далак, невросонография (метод за оценка на състоянието на структурите на централната нервна система).
- Възможна е и консултация.
Лечение на вътрематочна инфекция
Лечението зависи от патогена. Назначава:
- антибактериални лекарства;
- антивирусни лекарства;
- имуностимулиращи лекарства;
- укрепващи лекарства;
- симптоматични (в зависимост от симптомите и засегнатите органи) лекарства.
Усложнения и последствия
- Спонтанно прекъсване на бременността (спонтанен аборт).
- Вродени малформации на плода (особено ако инфекцията на плода настъпи през първите 2 месеца от неговото развитие).
- Ранна смърт на новородено (през първите 1-7 дни от живота).
- мъртво раждане.
- Дългосрочни последици (например нарушения в развитието на всякакви органи, мозъчни кисти и др.).
- развитие на вродена имунна недостатъчност.
- Други инфекции, придобити в бъдеще при деца с вътрематочна инфекция, се характеризират с тежко протичане, тежко увреждане на различни органи и системи. Възможен:
- инфекциозен процес при новородено (ако контактът с инфекция в плода е настъпил малко преди раждането, тогава детето може да се роди с пневмония (пневмония), ентероколит (възпаление на тънките и дебелите черва), менингит (възпаление на менингите) и т.н.);
- развитието на носителство на инфекциозен агент с риск от развитие на заболяването в бъдеще. Бактерионосителството е състояние, при което в организма има патогенен агент, но липсват клинични признаци на заболяването;
- ако детето се разболее много преди раждането, то може да се роди здраво, но с ниско телесно тегло (по-малко от 2500 грама).
Предотвратяване на вътрематочна инфекция
На етапа на планиране на бременността и по време на бременност:
- диагностика на бъдещата майка за наличие на полово предавани болести;
- кръвен тест за наличие на антитела (защитни тела) към инфекциозните агенти на TORCH-комплекс (например, ако по време на прегледа се окаже, че жената не е имала рубеола, тогава при планиране на бременност (поне 6 месеца предварително) , необходимо е да бъдете ваксинирани), ХИВ, сифилис (венерическо заболяване, засягащо кожата, лигавиците, вътрешните органи, костите, нервната система) и хепатит В и С;
- избягвайте контакт с болни роднини;
- преглед на домашни любимци (например котки за наличие на токсоплазмоза);
- не яжте бързо хранене, полуготови продукти, яжте само добре пържено месо и риба, откажете се от екзотична кухня;
- редовни посещения по време на бременност (1 път на месец през 1-ви триместър, 1 път на 2-3 седмици през 2-ри триместър, 1 път на 7-10 дни през 3-ти триместър);
- навременна регистрация на бременна жена в предродилна клиника (до 12 седмици от бременността);
- навременна подготовка за бременност и нейното планиране (навременна ваксинация, например срещу рубеола, откриване и лечение на заболявания на пикочно-половата система и др.);
- навременно и достатъчно лечение на инфекциозни и възпалителни заболявания на женската репродуктивна система.
Допълнително
- Най-опасните патогени, които почти винаги причиняват образуването на тежка патология на плода, са инфекциите, комбинирани в така наречения TORCH комплекс:
- Това (Toxoplasma gondii) - токсоплазмоза;
- R (Rubella virus) - рубеола;
- C (CMV) - цитомегаловирус;
- H (Herpes virus) - херпес.
- Болестите, предавани по полов път (хламидия, микоплазмени инфекции, трихомониаза, гонорея) също могат да причинят патологии на плода.
- Сифилисът също е особено опасен за плода.