Genetikai thrombophilia kezelése. A "lagis" laboratórium molekuláris genetikai vizsgálatai. Genetikai tényezők a policisztás petefészek szindróma, PCOS kialakulásában
Jellemzésére a "thrombophilia" kifejezést használják különféle jogsértések a véralvadási rendszerben, ami vérrögképződést eredményez. A thrombophiliát nem lehet különálló nozológiai egységnek vagy betegségnek tekinteni, hogy a „trombózissal” hasonlítsunk, hiszen ebben az esetben csak egy lehetőség vagy hajlam tükröződik. A valódi következmények kisebb-nagyobb valószínűséggel megjósolhatók.
A leggyakoribb mutációk
Ezen szekvenálási reakciók elemzése továbbra is kihívást jelent. Különösen nehéz megkülönböztetni a szekvenciahibákat a valódi mutációktól, és a legjobb, ha magas szintű lefedettséget használunk, pl. ugyanazt a sorozatot többször elemzik. Ezért a következő generációs szekvenálás eredményeit még meg kell erősíteni a Sanger-szekvenálással.
Genomvizsgálatok eredményei széles körű asszociációkkal
Mert vénás thromboembolia számos tanulmány készült széles genomkötéssel. E családok közül tizenkettőt választottunk ki idiopátiás thrombophiliában szenvedő próbák segítségével. A fennmaradó 9 családot fenotípustól függetlenül választottuk ki. Ezekben a vizsgálatokban kvantitatív tulajdonságlókuszokat találtak, de ezek a lókuszok gyakran tartalmaztak egy strukturális gént a vizsgált köztes fenotípushoz.
Az ICD-10 (Nemzetközi Statisztikai Osztályozás) szerint a patológia az "Egyéb alvadási rendellenességek" csoportba tartozik D68 kóddal a vér- és immunrendszer betegségeinek általános osztályában.
A vérzéscsillapító mechanizmus modern tanulmányai ( normál összetétel vér) lehetővé tette az örökletes és az élet során szerzett körülmények elkülönítését, köztulajdon amely a trombózisra és embóliára való hajlam megjelenése.
Genom asszociációs vizsgálatok eredményei
Három potenciális génlókuszt találtak, és ezeken a lókuszokon 109 gént újraszekvenáltak. Az esélyhányadosok 10-ig terjedtek.
Nagyon konzisztens eredmények összetett betegségek esetén
A nagy teljesítményű technológiát először korlátozott számú jelölt gén szekvenálására alkalmazták.Tudok szoptatni?
Ezeket az intervallumokat 142 elhízott egyénben és 147 kontrollcsoportban szekvenálták. Ritka variánsokat találtak a promoterszekvenciákban vagy azok közelében és más szabályozóelemekben, például e gének transzkripciós fokozóiban. A ritka változatokat is magában foglaló intervallumok extrém elhízással jártak. Ezeknek a változatoknak a többsége jelentéktelen allélgyakorisággal rendelkezett.
Miért veszélyes a thrombophilia?
A thrombophilia felismerésének és kezelésének problémája különösen fontos a kardiológiában és a neurológiában, mivel a szívkoszorúér- és agyi erek akut thrombotikus betegségei szilárdan az egyik vezető helyet foglalják el a lakosság mortalitásában, és valójában meghatározzák minden ember élettartamát. tizedik személy. A trombózis okai az esetek 80%-ában megállapíthatók.
A legtöbb fehérjemódosító mutációt a nagymértékben konzervált aminosavaknál találták. A vénás trombózis és más összetett betegségek genetikájával kapcsolatos jövőbeli kutatások nagymértékben támaszkodnak majd a jelenleg elérhetővé váló technológiákra. Ha a nagy áteresztőképességű kísérletek lebonyolításának költségei csökkennek, nagyobb populációk szekvenálhatók, valamint a genom nagyobb régiói. Jelenleg lehetséges az emberi genom egy teljes ágának rögzítése szekvenálás céljából, de ez még mindig túl drága a nagy vizsgálati populációk számára.
Minden thrombophiliát az etiológiai elv (eredet) szerint veleszületettre és eredetre osztanak. krónikus betegségek(szerzett). Az artériák vagy vénák károsodására való szelektív hajlam egyes thrombophiliák velejárója.
A 21. században a kardiológiának külön ága alakult ki - a kardiogenetika, amely a genetikai rendellenességek - mutációk - szív- és érrendszeri betegségekre gyakorolt hatását vizsgálja.
A végső cél a teljes emberi genom szekvenálása. A szekvenálók egyre több adatot tudnak generálni, de jelenleg a korlátozó tényező az adatelemzés és a vizsgált betegség eredményeinek értelmezése. Ezen a területen továbbra is fejlesztésekre van szükség az összetett betegségek ritka változataival kapcsolatos kutatások támogatása érdekében.
Mikor kell thrombophiliát tesztelni?
A jövőbeli kutatásoknak a génszabályozást és a génexpressziót befolyásoló egyéb mechanizmusokra is összpontosítaniuk kell. Ezek az epigenetikai változások már számos betegség, például rák, cukorbetegség és neurológiai rendellenességek etiológiájához kapcsolódnak. Ezen túlmenően a komplex betegségek vizsgálatánál célszerű lenne irányirányított módszereket alkalmazni. A biológiai rendszerek egészének variációja a gén-gén kölcsönhatások miatt fontosabb lehet, mint az egyes jelölt gének izolált genetikai variációja, és ez is lehet az oka annak, hogy a jelölt gének asszociációs vizsgálati eredményeinek replikációja gyakran sikertelen.
Mi a különbség az artériás és a vénás trombusok között?
Az artériákban és vénákban kialakuló vérrögök közötti különbségek képződési mechanizmusuk mögött rejtőznek. Ezt figyelembe kell venni, mivel az artéria elzáródása veszélyesebb az emberi egészségre.
Artériás vérrögök keletkeznek az artériákban és a szívkamrák belsejében. A készítmény fibrin hidakkal összekapcsolt vérlemezke sejteket tartalmaz. Ezért van fehér szín. Ritkán teljesen blokkolja az edény átmérőjét. Az iskoláztatásban vezető szerepet játszanak:
Ha mélyebben megértjük ezeket az adatokat a vénás thromboembolia genetikai architektúrájában és a betegség kialakulásában fontos útvonalakon, akkor a személyre szabott előrejelzés és kezelés valósággá válhat. A thrombophilia családokon végzett vizsgálatok alapján, amelyek a fenotípus penetranciájában változékonyságot mutattak, azt sugallták, hogy a thrombophilia oligogenetikai rendellenesség. A megállapított genetikai kockázati tényezők azonban nem magyarázzák a vénás thromboembolia általános öröklődését, ami arra utal, hogy a genetikai kockázati tényezőket még nem fedezték fel.
- érrendszeri betegségek (atherosclerosis, arteritis);
- a szív és az érrendszer veleszületett rendellenességei;
- vérlemezkék aktiválása;
- fertőző betegségek;
- gyógyszerek hatása.
A vörös trombus kezdeti képződésének parietális jellege jellemző a fő vénákra
A vénás trombózis vörösvértestekből és fibrinből jön létre. A trombus vörös. Teljesen lezárja a véna lumenét. 2-szer gyakrabban fordul elő, mint az artériás. Az oktatási mechanizmus a következőkön alapul:
Az asszociációs tanulmányok közös érzékenységi mintákat keresve próbáltak ilyen felfedezéseket tenni, de ezeknek a tanulmányoknak a hozzájárulása korlátozott volt. Más vizsgálatokat kell végezni a vénás thromboembolia új genetikai meghatározóinak felkutatására. A nagy áteresztőképességű szekvenálási technológia bevezetésével a ritka változatok ma már közvetlenül azonosíthatók egy jelölt gén megközelítéssel vagy teljes szekvenciákkal. Az adatelemzés marad a leginkább nagy probléma az ilyen típusú tanulmányokban.
A betegségekben szerepet játszó új gének és útvonalak azonosításának legmegfelelőbb és elfogulatlan módszere a teljes genom szekvenálási megközelítés lenne, de ez még nem valósítható meg nagy populációkban. A vénás thromboemboliával foglalkozó közös elemzési csoport.
- fokozott véralvadás;
- csökkent véráramlás (stasis).
Mit tudunk a veleszületett thrombophilia természetéről?
A genetikai thrombophiliát először a 20. század közepén fedezték fel vénás trombózisban szenvedő betegeknél. Ez a természetes véralvadásgátló folyamathoz szükséges anyagok elégtelenségéből áll a következők miatt:
Genetikai thrombophilia tesztek
A plazma trombin képződésének gátlása fibrinképződéssel. Az idiopátiás thrombophilia genetikai elemzése. Az emberi genom változási térképe a szekvenálási szekvenciából. Azok az egyének, akik e gének egyikében patogén variánst örökölnek, hajlamosak a túlzott vérrögképződésre, leggyakrabban a lábakban.
Az örökletes thrombophiliában szenvedő nők szintén rendelkeznek megnövekedett kockázat vetélés és a terhesség egyéb szövődményei. A diagnózis felállítása vagy megerősítése, a jövőbeni trombózisos események kockázatának előrejelzése, illetve a kezelési és kezelési döntések meghozatala érdekében hasznos lehet azonosítani azokat a személyeket, akiknek genetikai hajlamuk van a vérrögképződésre. A betegséget okozó változat azonosítása megkönnyíti a veszélyeztetett rokonok vizsgálatát és diagnosztizálását is.
- szintézisük blokkolása;
- specifikus fehérjekomplexek kötő hatása;
- fokozott roncsolás a proteolitikus enzimrendszerek által.
Ennek eredményeként a vérzéscsillapítás túlsúlya a fokozott koagulálhatóság irányába lép fel. A természetes antikoagulánsok a következők:
- véralvadási faktorok (IX, X, XI és XII);
- trombin;
- protein C - képes feloldani a trombint alkotó Va és VIIIa faktorokat;
- protein S - a C fehérje biokémiai reakcióinak kofaktoraként szolgál, aktiválja azt.
Az S és C fehérjék hiányát az anomáliás betegek 20% -ában, más adatok szerint 40% -ában találták. Ez a leggyakoribb génmutáció. Az arginin aminosav pótlása okozza. Ez a mutáció a leggyakoribb az európaiak körében (legfeljebb 15%). Amerika, Ázsia és Afrika őslakosai között nem található.
A gének egyéni megválasztása
Az örökletes thrombophilia általában egy felnőtt által okozott betegség, amely hajlamosítja az embereket vérrögképződésre. Ha kialakult, a vérrögök továbbhaladhatnak, és befolyásolhatják a véráramlást a test más részeibe, például a tüdőbe. Az örökletes thrombophiliában szenvedő nőknél fokozott a vetélés vagy más terhességi szövődmények kockázata. Ezen kívül néhány ritka formák az örökletes thrombophilia csecsemőknél életveszélyes lehet.
Míg a legtöbb örökletes thrombophiliában szenvedő embernél soha nem alakulnak ki rendellenes vérrögök, számos tényező növelheti a kockázatot, beleértve az előrehaladott életkort, a műtétet, a sérülést, az inaktivitást és a terhességet. Több örökletes véralvadási rendellenesség jelenléte is befolyásolhatja a kóros véralvadás kockázatát.
Attól függően, hogy a mutáns gént az egyik vagy mindkét szülőtől kapták, hordozó állapot alakul ki, amelyet heterozigóta és homozigóta néven neveznek:
- az első esetben 3-8-szorosára nő a thromboembolia kialakulásának kockázata a rokonok körében az élet során;
- a másodikban akár 50-100-szorosára is megnövekszik, és fiatal korra esik.
A II-es faktor (protrombin) változása az európai lakosok 1-4% -ánál található, a világ más részein gyakorlatilag nem találhatók meg. A veleszületett thrombophilia és az azt követő artériás trombózis kialakulásának kockázata akár 8-szorosára nő, ami a fiatalokat fenyegeti.
A thrombophilia vizsgálatának költsége
A trombózis kialakulásának élethosszig tartó kockázata az érintett géntől függően 4-80-szor magasabb lehet, mint az általános populációé. A patogénnek vagy valószínűsíthetően patogénnek minősített változatokat ortogonális módszerekkel támasztják alá, kivéve az egyedi változatokat, amelyek pontszámai Jó minőségés korábban legalább tíz nem kötött mintában megerősítették. Elemzésünk az intragén deléciók és duplikációk többségét egyetlen exon felbontásban észleli. Azonban in ritka esetek Előfordulhat, hogy az egy-exon példányszámú események nem elemezhetők az inherens szekvenciatulajdonságok vagy az izolált adatok romlása miatt. Ha egy adott egy-exon példányszám-változat felfedezését kéri, rendelés előtt forduljon az ügyfélszolgálathoz. Klinikai irányelveköröklött thrombophilia vizsgálatára. A férfiak és a nők egyaránt érintettek.
A 21. század eleje lehetővé tette több, egymástól függetlenül ható, vagy egymást erősítő genetikai tényező örökletes hatásának egyidejű azonosítását. Az ilyen kombinációkat a sejtekben lévő DNS-polimorfizmus okozza. A thrombophilia típusát "multiformnak" nevezik.
A genetikai polimorfizmus a vérplazmában lévő tényezőkre jellemző:
Súlyos koraszülöttkori retinopátia is előfordulhat. A heterozigóta betegek általában felnőtt korukig tünetmentesek. A trombózisos epizódokat főként egyéb kockázati tényezők, például műtét, terhesség vagy immobilizáció váltják ki. A betegség leggyakoribb megnyilvánulása a mélyvénás trombózis. Alsó végtagok embóliával pulmonalis artéria vagy anélkül. Artériás trombózis is előfordulhat. Három biológiai forma létezik.
A molekuláris vizsgálat elérhető, de nem szükséges a diagnózishoz. Az átvitel autoszomális recesszív. Friss fagyasztott plazma beadására lehet szükség az újszülöttkori fulmines purpura kezdeti kezelésére. Műtéti beavatkozások szükséges lehet a trombózisos elváltozások eltávolításához. A trombózisban szenvedő betegeket véralvadásgátló kezeléssel kezelik. Figyelmet kell fordítani a kumarin által okozott bőrelhalás kockázatára. Megelőző kezelés Erősen pozitív családi anamnézissel rendelkező thromboticus megbetegedés esetén, a peripartum időszakban vagy perioperatívan javasolt.
- Zavar a fibrinogén szint - káros hatása a prognózisra szívizom ischaemiában, összefüggése az atherosclerosis kialakulásával bizonyított.
- Az I-es típusú plazminogén aktiválódását elnyomó gén - polimorfizmus eredményeként nem képződik aktív plazmin, vagy a plazminogén nem alakul át plazminná.
A plazminogén aktivátorok inhibitorának (Plasminogen Activator Inhibitor-1, PAI-1) szerepe a zsíranyagcsere, érelmeszesedés kialakulása, elhízás, szülészeti patológia. Negatívan befolyásolja a dohányzás, a magas vérnyomás.
Örökletes thrombophilia terhesség alatti kezelése
A prognózis rossz homozigóta vagy komplex heterozigóta betegeknél. A prognózis kedvező a heterozigóta betegek számára. Megfelelő kezeléssel és monitorozással a thromboemboliás megbetegedések kockázata jelentősen csökken. A halálozás a tüdőembólia következménye lehet.
A részleges hibák sokkal gyakoribbak. Azok a betegek, akiknél a protein C szintje nem mutatható ki, általában a születés után órákkal vagy napokkal jelentkezik, lila fulminánsokkal vagy masszív vénás trombózissal. Az alacsony, de kimutatható protein C-szinttel rendelkező betegek tünetei enyhébbek, általában hasonlóak a heterozigóta egyénekéhez. A heterozigóta protein C-hiányban szenvedő betegek általában felnőtt korukig tünetmentesek.
- XII. faktor hiánya - szintén felelős a plazminogén plazminná történő átalakulásáért.
- A fibrinrögképződés megsértése a XIII-as faktor hatására, magas aktivitást igazoltak szívinfarktusban szenvedő betegeknél.

Számos lehetőség kínálkozik a DNS szerkezetének megváltoztatására egyes aminosavak, teljes gének és szakaszaik cseréjével.
Az agy vagy a mesenterialis mirigy trombózisa is előfordulhat. A fehérje C aktivitási szintje 0 és 30% között van súlyos hiányosságok esetén és 30 és 70% között részleges hibák esetén. A betegségnek két biológiai formája van. Fehérje C koncentrátumok vagy frissen fagyasztott plazma beadása megtörtént alapvetőújszülöttkori lila fulminánsok kezdeti kezelésére.
A prognózis súlyos lehet homozigóta vagy komplex heterozigóta betegeknél. Németországban például ötször több ember belehal a trombózis következményeibe, mint egy autóbalesetbe. Ez nem feltétlenül így van: a trombózis-profilaxis gyógyszerekkel például csökkentheti a trombózis és embólia előfordulását kockázati helyzetekben. Ehhez azonban a thrombophilia hatékony előzetes diagnosztizálására van szükség a veszélyeztetett betegek azonosításához. A "trombózis" kifejezést az elzáródásra használják véredény vérrög, amely a véralvadás során fellépő hibás működés miatt alakul ki.
A DNS-polimorfizmus az egyik vezető változás a vérlemezkékben, amely hatással van:
- sejtadhézió (aggregáció) - a szívizom ischaemia fő kockázati tényezőjének számít, mivel Európában a hordozás a lakosság 35%-át érinti;
- az érfal kollagénszintézisét befolyásoló, megváltozott immuntulajdonságokkal rendelkező glikoprotein tartalmát az európai lakosok 15%-ánál találták meg.
A vérben bekövetkező örökletes hematogén változások tanulmányozása összetett kölcsönhatási mechanizmust tárt fel génmutációk külső provokáló szerzett tényezőkkel, ezek kombinációinak, változatainak létrehozása. Ezt fontos figyelembe venni a betegterápia tervezésekor.
Az örökletes thrombophilia klinikai képének jellemzői
A veleszületett thrombophilia leggyakrabban a lábak mély fővénáinak trombózisában nyilvánul meg (az esetek 90% -ában), ilyen eseteket ritkán figyelnek meg. súlyos szövődmények mint a tüdőembólia.
Az agyi és a mesenterialis vénák zónáinak trombózisos megnyilvánulásai akár 5% -ot tesznek ki. Ezek az esetek jellemzőbbek az S és C fehérje hiányára. Jellemző, hogy minden elváltozás, beleértve a szövődményeket is, 40 év alatti betegeknél alakul ki. trombózis be artériás rendszer nem jellemző az örökletes formákra.
súlyossága klinikai rendellenességek a koagulálhatóság az öröklődés típusától függ:
- homozigóta átvitel esetén gyakrabban születnek életképtelen gyermekek, az első napokban vagy hetekben meghalnak, lehetséges a fulmináns vérzéses purpura kialakulása az első életévben;
- heterozigótákban trombózisok alakulnak ki és jelennek meg epizodikusan, hosszú ideig titokban haladnak, a thrombophilia tünetei külső provokáló tényezőtől függenek.
Aktiválja Klinikai tünetek lehet:
- sérülés;
- terhesség;
- műtéti beavatkozás;
- hormonális fogamzásgátlók szedése;
- a hosszan tartó ágynyugalom szükségessége.
Az ilyen kombinációkban a trombózis kockázata visszafordíthatatlan.
Mi a trombózis szerzett kockázati tényezője?
Számos krónikus betegség és kóros állapotok fokozott trombózishajlam kíséri. Ezt a tervezés során különösen figyelembe kell venni orvosi beavatkozások. A trombózis leggyakoribb szövődményei a következők:
- intravénás manipulációk (az összes trombózis 90%-a), a beépített katéterrel ellátott nagy szubklaviatól a cubitalisig és a kis kézen, minél hosszabb ideig van a katéter a vénában, annál nagyobb a trombózis valószínűsége;
- megnövekedett vér viszkozitása a keringés teljes térfogatának jelentős csökkenésével (bármilyen típusú hipovolémia, masszív vérveszteség), policitémiával járó betegségek (a vérelemek számának növekedése és növekedése);
- sérülés;
- sebészeti beavatkozások;
- fertőzések (pl. bárányhimlő, thrombophlebitis, HIV);
- a szív és a nagy erek veleszületett rendellenességei;
- autoimmun betegség ( szisztémás lupus, antifoszfolipid szindróma);
- cukorbetegség;
- vesekárosodás nefrotikus szindrómával, amikor a kiválasztó funkció károsodott;
- onkológiai betegségek és kezelésük módszerei (kemoterápia, sugárterhelés);
- a májszövet krónikus betegségei;
- hormonális fogamzásgátlók, kortikoszteroidok, koncentrált fehérjék szedése.
A szerzett thrombophilia megnyilvánulásai
A szerzett thrombophilia leggyakoribb súlyos megnyilvánulása a hyperhomocysteinemia és az antifoszfolipid szindróma.
A homocisztein felhalmozódása
A hyperhomocysteinemia veleszületett és szerzett formában egyaránt előfordul.

A hyperhomocysteinemia időben történő diagnosztizálása lehetővé teszi a terhesség alatti vetélés okának azonosítását, a szövődmények elkerülése érdekében
A homocisztein az egyik fontos biológiai anyag, amely biztosítja a metionin és a sók metabolizmusát. folsav(folsav) a májsejtekben. A kémiai képlet ként tartalmaz, ezért 25 µmol / l vagy annál nagyobb felhalmozódás esetén mérgező tulajdonságokkal rendelkezik. A homocisztein részt vesz:
- metilációs folyamatok;
- heparin, glutation, kondroitin-szulfát szintézise;
- a biokémiai reakciók folátciklusa, amely folátokat képez a későbbi nukleinsavak előállításához.
A sejten belül metabolikus reakciók mennek végbe a B-vitaminok, mint enzimek és kofaktorok közvetlen részvételével, amelyek bizonyos szintű homociszteint biztosítanak, eltávolítva a felesleges mennyiséget. A kiválasztás és a szintézis aktiválásának megsértése esetén a következőkről van szó:
- enzimgének mutációja;
- a folátok és a B-vitaminok (különösen a B6 és B12) hiánya az élelmiszerekben;
- gyakori stressz reakciók;
- vesebetegségek, amelyeket a kiválasztási funkció megsértése kísér.
Ezen tényezők kombinációja hyperhomocysteinaemiához vezet. Ennek eredményeként:
- a vaszkuláris endotélium szerkezete zavart;
- a természetes antikoagulánsok aktivitása és a fibrinolízis folyamata blokkolva van.

Egy elemző eszköz, amely lehetővé teszi specifikus antitestek kimutatását
A foszfolipidek elpusztítása
Az antifoszfolipid szindróma csak szerzett változatként lehetséges, leggyakrabban trombózisos betegségekben észlelhető. Vizsgálata lehetővé tette az autoimmun természet megállapítását. A páciens testében antitestek jelennek meg saját foszfolipid komplexei ellen.
NÁL NÉL klinikai gyakorlat valamiben kifejezve:
- artériás és vénás trombusok megjelenése;
- thrombocytopenia;
- a vetélés veszélye;
- neurológiai betegségek.
Ritkán megfigyelhető:
- kardiomiopátia,
- májgyulladás,
- vasculitis,
- hemolitikus anémia,
- veseelégtelenség.
Az antitestek három csoportját azonosították, amelyek különböző módon blokkolják az antikoagulációs folyamatokat:
- lupus-szerű véralvadásgátló;
- antikardiolipin;
- affinitást mutat a β2-glikoprotein1 iránt.
A tudósok még nem jöttek rá, hogy ezek az antitestek az antifoszfolipid szindróma feltétlen "bűnösei", vagy egyszerűen csak kísérik azt. Végül is 5%-a teljesen egészséges emberek a felsorolt antitesteket is kimutatják.
A klinika szerint vannak:
- elsődleges forma - korábbi patológia nélkül, a betegek 70% -ában fordul elő;
- másodlagos - körülbelül 30% -át teszi ki, különböző autoimmun betegségek hátterében (vírusos és bakteriális fertőzések, diabetes mellitus, daganatok, bélgyulladás).
A klinikai kép kifejezett többszörös mikrotrombusokban és embólusokban nyilvánul meg különböző erekben, amelyek egyszerre több szervet és rendszert érintenek: akut szívrohamok a szívizomban, a vesékben, tüdőszövet, máj, ischaemiás stroke agy.
A szindróma súlyos formájának okai a következők:
- az antikoagulánsok bevitelének hirtelen megszakítása;
- rosszindulatú daganat előfordulása;
- akut fertőző betegségek átvitele.
A thrombophilia diagnózisa
A thrombophilia elemzése a diagnózist két részre osztja:
- genetikai változások tanulmányozása;
- a károsodott funkciók azonosítása a megváltozott véralvadási mechanizmus végeredménye alapján.
A trombofília fontos és az orvostudomány által elismert genetikai markerei egy megerősített polimorfizmus:
- V. faktor gén (Leiden);
- faktor II gén (protrombin).
A laboratóriumi vizsgálatokat "in vitro" végzik, ami azt jelenti, hogy "üvegen"
Egy elterjedtebb koncepció szerint ezekhez nincs szükség állatok fertőzésére vagy szervi struktúrák in vivo vizsgálatára.
A genetikusok megkülönböztetik az öröklődés típusát (homo- vagy heterozigóta), és jelzik az eredményt az elemzés dekódolásában.
A leginformatívabb funkcionális tesztek közé tartozik a szintek meghatározása:
- protein C;
- protein S;
- antitrombin III;
- VIII faktor.
Feltétlenül vizsgálja meg az aktivált protein C-vel szembeni rezisztenciát (rezisztencia – APC) és a trombinidőt a fibrinogén anomáliák kimutatása érdekében.
Az antifoszfolipid szindróma immunmarkerjeként a foszfolipidek (kardiolipin, foszfatidil-szerin, foszfatidil-etanol-amin és foszfatidil-inozitol) elleni specifikus antitestek kimutatása használható.
A diagnózist bonyolítja a szokásos koagulogram változásának hiánya.
Kutatási algoritmus hiperhomocisztémiára
Nem szabad kihagyni lehetséges patológia tisztázatlan vérzési rendellenesség esetén a következő sémát kell követni a vizsgálatokra történő beutalásnál:
- először a vénás trombózisban szenvedő nőket kell megvizsgálni 45 év alatti, artériás trombózisban szenvedő nőket - 35 éves korig;
- visszatérő vetélésben szenvedő nők;
- korábban megállapított thrombophiliában szenvedő betegek családtagjai.
A homocisztein szintjét a vérplazmában a következő módszerekkel határozzák meg:
- gázkromatográfiás spektroszkópia;
- fluoreszcens módon;
- aminosav analizátorok használata;
- enzim immunoassay "világító" antitestek részvételével.
Megkötni fokozott koncentráció A homocisztein mikrotrombózis klinikájával egyes tudósok ragaszkodnak a kezelés során végzett ismételt elemzésekhez, figyelembe véve a beteg korát és nemét, valamint a terhesség jelenlétét.
Megállapította, hogy:
- gyermekben a homocisztein koncentrációja nem haladja meg az 5 μmol / l-t;
- 45 év alatti nőknél - 1/5-tel alacsonyabb, mint a férfiaknál;
- terhesség alatt a trimesztertől függően 5,6-ról 3,3 µmol / l-re csökken.
Kezelés
A thrombophilia kezelését a patológia formája és súlyossága határozza meg.
Hyperhomocysteinemia esetén a homociszteinszint csökkenése érhető el:
- foláttal dúsított étrend;
- folsav és B 6 és B 12 vitamin komplex kijelölése.
Ezek a vitaminok felgyorsítják biokémiai folyamatok felesleges anyag ártalmatlanítása. Az adagot és a kezelés időtartamát az orvos határozza meg. A fenntartó terápia általában jelentős dózisok alkalmazása után javasolt.

A folsav maximális koncentrációja a földimogyoróban és a májban található
- földimogyoró és dió;
- hús (marhahús, csirke, máj);
- hüvelyesek;
- brokkoli;
- árpa dara;
- spenót.
A természetes antikoagulánsok igazolt hiánya esetén a betegnek helyettesítő terápiára van szüksége. A kezelés magában foglalja:
- protein C koncentrátumok;
- frissen fagyasztott plazma transzfúziója (természetes antikoagulánsok forrásaként);
- vérlemezke szuszpenzió.
Ha azonosítják másodlagos ok thrombophilia, az alapbetegség kezelése szükséges.
A thrombophilia orvosi gyakorlatban történő felismerése alapvető fontosságú. Ez nemcsak a trombózis nagy valószínűségét jelzi a betegben, hanem a súlyos szövődmények megelőzésére szolgáló terápia megválasztását is egy adott esetben. Az öröklött és az interakció egyéni kockázatának elszámolása és tanulmányozása külső okok- az orvostudomány jövője.
A szervezet hajlamának állapota a vaszkuláris trombózis kialakulására, amely kiújulhat és előfordulhat eltérő lokalizáció thrombophiliának nevezik. A betegség lehet genetikai vagy szerzett. A patológia oka leggyakrabban Klinikailag a betegség számos különböző lokalizációjú trombózisban nyilvánulhat meg. A thrombophilia meglehetősen gyakori a lakosság körében, és előfordul különböző formák. A betegség orvosi vagy sebészeti kezelést igényel.
Trombofília: mi ez?
A patológia a vérrendszer betegségeire utal, amelyek vérrögképződésre való hajlamban és a hemosztázis károsodásában nyilvánulnak meg. A thrombophiliában többszörösen visszatérő trombózisok fordulhatnak elő trauma, műtét, fizikai túlerőltetés vagy terhesség következtében. Az állapot veszélyes, mert olyan szövődményekhez vezethet, mint tüdőembólia, szélütés, szívinfarktus.A gyakran elhanyagolt formák halálhoz vezetnek.
Az orvostudomány számos területe foglalkozik a thrombophilia kutatásával, diagnosztizálásával és kezelésével. A hematológia tanulmányozza a vér tulajdonságainak megsértését, a flebológiát - a vénás erek trombózisának diagnosztizálására és kezelésére szolgáló módszereket, az érsebészek a vérrögök eltávolításával foglalkoznak. A trombus kialakulása a normális véráramlás megzavarásához vezet, amihez veszélyes, nehezen kezelhető állapotok alakulnak ki. A probléma időben történő megelőzése érdekében rendszeres időközönként elemzést kell végezni a nők számára, például vénás vér 5-10 perc.
A fejlesztés okai
Számos tényező okozza a patológia kialakulását. Szinte minden ember tapasztalhat olyan betegséget, mint a thrombophilia. Mi ez a veszélyes állapot, sok beteg néha nem is sejti, és későn kér segítséget. Van egy lista az okokról, amelyek hozzájárulhatnak a patológia kialakulásához.
Az örökletes (vagy genetikai) thrombophilia a betegségre való genetikai hajlam eredménye. Korábbi vérbetegségek (trombocitózis, eritremia, antifoszfolipid szindróma) is kiváltó okai lehetnek a kialakulásának. A kockázati tényezők közé tartozik az érelmeszesedés, rosszindulatú daganatok, pitvarfibrilláció, visszér erek, autoimmun betegség. A thrombophilia valószínűsége stroke vagy szívroham után nő. Azok a betegek, akik elhízottak, ülő életmódot folytatnak, vegyenek hormonális fogamzásgátlók, alultáplált, súlyos sérülést vagy műtétet szenvedtek a múltban. NÁL NÉL fiatalon a betegség ritka, leggyakrabban időseknél alakul ki. A betegség megelőzése, vagy az állapot elmulasztása érdekében ajánlott időnként thrombophilia-vizsgálatot végezni.
Klinikai kép
A patológia klinikai megnyilvánulásait a tanfolyam zökkenőmentes növekedése és időtartama jellemzi, így a betegek nem észlelik azonnal az egészségi állapotuk változásait, és nem tesznek panaszt. Laboratóriumi mutatók képes diagnosztizálni a thrombophiliát, és előrehaladott klinikai kép egyes esetekben csak néhány év múlva jelenik meg. Élénk tünetek figyelhetők meg, ha már kialakult a vérrög. Az ér lumenének elzáródásának mértéke és a trombus lokalizációja befolyásolja a tünetek súlyosságát.
által okozott artériás trombózis vérrögök az artériás ágy ereinek lumenében, amelyet vérrögök képződése kísér a placenta ereinek lumenében, méhen belüli magzati halál, többszörös vetélés, akut rohamok koszorúér-elégtelenség, ischaemiás stroke.
Az alsó végtagok vénás trombózisával klinikai tünetek trofikus változásokként jelennek meg. bőr, az alsó végtagok erős duzzanata, a fájdalom megjelenése, az alsó végtagok nehézségi érzése.
Trombofília terhesség alatt
A terhesség alatt a genetikai vagy örökletes thrombophilia gyakran először jelentkezik. Ez mindenekelőtt a harmadik, a méhlepény keringési körének megjelenéséből adódik, ami további terhet ró a keringési rendszerre. A vérrögök képződése szintén hozzájárul a placenta körének számos jellemzőjéhez. A méhlepényben nincsenek kapillárisok, az artériákból az anya vére jut be, majd a chorionbolyhokon át a köldökzsinórba kerül.
A terhes nő szervezetét fokozott véralvadás jellemzi, ami csökkenti a vérveszteséget a szülés során, vagy olyan szövődmények esetén, mint a vetélés vagy a méhlepény leválása. Növeli a vérrögök kialakulásának kockázatát, és ebben rejlik a veszély. Ha a méhlepényhez vezető erekben lokalizálódnak, akkor nem jutnak be a magzati testbe tápanyagok, hipoxia lép fel. Az erek elzáródásának mértékétől és a vérrögök számától függően súlyos szövődmények következhetnek: koraszülés, vetélés, terhesség elhalványulása, magzati fejlődési rendellenességek vagy halálozás, magzati placenta elégtelenség, méhlepény-leválás. Általában 10 hét után jelennek meg. Többért korai időpontok A terhesség alatti thrombophilia nagyon ritka. Ha a betegség 30 hét után alakul ki, akkor sok esetben méhlepény-leválással, méhlepény-elégtelenséggel vagy a preeclampsia súlyos formáival végződik. A vizsgálat során az orvosnak figyelmet kell fordítania a véralvadásra, amelynek "pozíciójában" lévő nők normája kissé eltér az általánosan elfogadotttól.
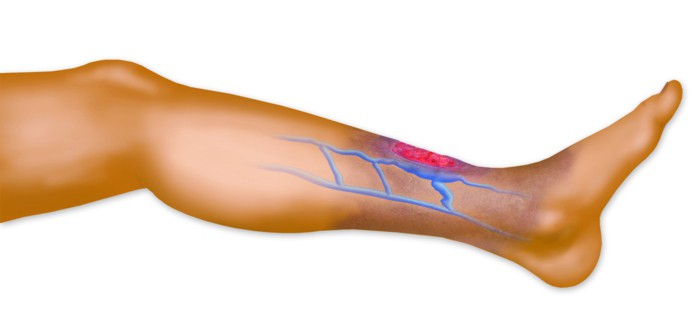
Diagnosztika
A trombózis klinikai megnyilvánulásait a klinikán laboratóriumi (citológiai, biokémiai, genetikai, koagulológiai) és instrumentális módszerek. Által megjelenésés a test állapota alapján megállapíthatja a gyanút vénás trombózis(ödéma). Mind a vénás, mind az artériás konstans kíséri nyomó fájdalmakés a szétrobbanás érzése. Néha a lokalizációs területen a bőr hőmérséklete emelkedik (vénás). Az artériás trombózissal a trombusképződés helye közelében a hőmérséklet csökkenése, cianózis (cianózis) és erős fájdalom jelentkezik. A felsorolt tünetek a thrombophilia első markerei, ami a legfontosabb ok a szakorvoshoz való felkeresésre.
Közvetlenül a kórházban alaposabb vizsgálatokat végeznek a beteg állapotáról. Szükséges a thrombophilia elemzése, az erek ultrahangvizsgálata (meghatározza a trombus jellegét, méretét és lokalizációját), kontrasztos arteriográfiát és venográfiát, amely lehetővé teszi a trombózisos folyamatok anatómiájának lokalizálását és feltárását. Ezenkívül röntgen-, radioizotópos módszereket, a polimorfizmusok genetikai elemzését, a homocisztein-koncentráció meghatározását használják.
Kezelés
A betegség leküzdésének kérdése felmerül azokban, akik thrombophilia diagnózissal szembesülnek. Mi ez és hogyan kell kezelni, hogy elkerülje súlyos következményekkel jár? A patológia kezelésének átfogónak kell lennie, és különféle szakterületek orvosainak részvételével kell elvégezni: érsebész, phlebológus, hematológus. Az első szakaszban meg kell vizsgálni a betegség kialakulásának etiopatogenetikai mechanizmusait. pozitív eredményeket kezelés csak a kiváltó ok megszüntetése után várható. A terápia fontos eleme a diéta, amely az élelmiszerek kizárásából áll magas szint koleszterin, korlátozza a zsíros és sült ételek fogyasztását. Javasoljuk a szárított gyümölcsök, zöldségek és gyümölcsök, friss fűszernövények étrendjét.
A gyógyszeres kezelés a vérlemezke-ellenes szerek kijelöléséből áll, amelyet antikoaguláns terápia, terápiás véralvadás és hemodilúció egészít ki. Bizonyos esetekben szükség van friss fagyasztott plazma transzfúziójára heparinizálással kombinálva. Az antitrombin III hiánya által okozott örökletes formára helyettesítő terápiát írnak elő.
Az enyhe thrombophiliát (a vérvizsgálat segít meghatározni a formát) liofilizált plazmával (intravénásan) vagy száraz adományozott plazmával kezelik. Nál nél súlyos formák fibrinolitikus gyógyszereket használnak, amelyeket katéter segítségével az eltömődött ér szintjén adnak be. A thrombophilia diagnózisával a kezelést egyénileg kell kiválasztani és átfogóan kell kezelni, amely biztosítja a gyors és hatékony gyógyulást.
Megelőzés
Ennek elkerülése érdekében komoly betegség vagy szövődményei, időszakonként szükséges elvégezni megelőző intézkedések hogy figyelmeztessem őt. A thrombophiliában szenvedő betegeknek ajánlott alacsony dózisú plazmatranszfúziót és a "Heparin" gyógyszer szubkután beadását végezni. A beteget profilaxisra kell felírni gyógyszerek amelyek erősítik érfal("Trental" intravénásan, "Papaverine" szájon át).
A thrombophilia megelőzésére és kezelésére javasolt a használata népi gyógymódok, például, orvosi növények. Szóval, áfonya tea ill szőlőlé. A magvak tinktúrájával hígíthatja a vért Japán Sophora. Ezenkívül kívánatos elkészíteni megfelelő étrend táplálkozás, gyakrabban sétálni friss levegőés hagyjon fel rossz szokásokkal.