Къде се намира фосфорът в природата? Фосфор и неговите съединения – Хипермаркет на знанието
>> Химия: Фосфор и неговите съединения
Строеж и свойства на атомите . Следващият след азота представител на основната подгрупа на V група на Периодичната таблица е неметалният елемент фосфор R. Атомите в сравнение с азотните атоми имат по-голям радиус, по-ниска стойност на електроотрицателност и следователно по-изразени редукционни свойства. Съединенията със степен на окисление -3 на фосфорния атом са по-рядко срещани от тези на азота (само във фосфиди - съединения на фосфор с метали, например Ca3P2, Na3P). По-често фосфорът показва степен на окисление +5 в съединенията. Но неговото съединение с водород - фосфин PH3 - е рядък случай, когато ковалентната връзка между атомите на различни елементи е неполярна поради факта, че електроотрицателността на фосфора и водорода има почти еднакви стойности.
Фосфорът е просто вещество. Химичният елемент фосфор образува няколко алотропни модификации. От тях вече знаете две прости вещества: бял фосфор и червен фосфор.
Белият фосфор има молекулярна кристална решетка, състояща се от P4 молекули. Неразтворим във вода, разтворим във въглероден дисулфид. Лесно се окислява във въздуха и дори се запалва под формата на прах.
Белият фосфор е много отровен. Специалното му свойство е способността да свети в тъмното поради окисляването му. Съхранява се под вода.
Червеният фосфор е тъмночервен прах. Не се разтваря нито във вода, нито във въглероден дисулфид. На въздух се окислява бавно и не се запалва спонтанно. Не е отровен и не свети в тъмното.
Когато червеният фосфор се нагрява в епруветка, затворена с памучен тампон, той се превръща в бял фосфор (концентрирани пари), а ако тампонът се издърпа, във въздуха ще мига бял фосфор (фиг. 35). Този експеримент показва запалимостта на белия фосфор.
Химическите свойства на червения и белия фосфор са подобни, но белият фосфор е по-химически активен. И така, и двамата, както подобава на неметалите, взаимодействат с метали, образувайки фосфиди:
Белият фосфор се запалва спонтанно във въздуха, докато червеният фосфор изгаря при запалване. И в двата случая се образува фосфорен оксид, който се отделя под формата на гъст бял дим:
4P + 502 = 2P205

Ориз. 35. Експеримент, илюстриращ прехода на червения фосфор към бялото
Фосфорът не реагира директно с водорода; фосфинът PH3 може да се получи индиректно, например от фосфиди:
Ca3P2 + 6HCl = 3CaCl2 + 2PH3
Фосфин- силно отровен газ с неприятна миризма. Лесно запалим във въздуха. Това свойство на фосфина обяснява появата на блатото.
Фосфорни съединения
. При изгаряне на фосфин или фосфор, както вече знаете, се образува фосфорен оксид P205 - бял хигроскопичен прах. Това е типичен киселинен оксид, притежаващ всички свойства на киселинните оксиди.
Фосфорният оксид съответства на фосфорната киселина H3P04. Това е твърдо прозрачно кристално вещество, силно разтворимо във вода във всяко съотношение. Като триосновна киселина H3P04 образува три серии соли:
средни соли или фосфати, например Ca3(PO4)2, които са неразтворими във вода, с изключение на фосфати на алкални метали;
киселинни соли - дихидрогенфосфати, например Ca(H2P04)2, повечето от които са силно разтворими във вода;
киселинни соли - хидрофосфати, например CaHPO4, които са слабо разтворими във вода (с изключение на натриеви, калиеви и амониеви фосфати), т.е. те заемат междинна позиция между фосфати и хидрофосфати в разтворимостта.
В природата фосфорът не се среща в свободна форма - само под формата на съединения. Най-важните естествени фосфорни съединения са минералите фосфорити и апатити. Основната им маса е калциев фосфат Ca3(P04)2, от който се получава промишлено фосфор.
Биологично значение на фосфора. Фосфорът е постоянен компонент на тъканите на човешки, животински и растителни организми. В човешкото тяло повечето фосфор е свързан с калций. За да изгради скелет, детето се нуждае от толкова фосфор, колкото и калций. Освен в костите, фосфорът се намира в нервната и мозъчната тъкан, кръвта и млякото. В растенията, както и в животните, фосфорът е част от протеините.
От фосфора, постъпващ в човешкото тяло с храната, предимно яйца, месо, мляко и хляб, се изгражда АТФ - аденозинтрифосфорна киселина, която служи като колектор и носител на енергия, както и нуклеиновите киселини - ДНК и РНК, които пренасят наследствени свойства на тялото. АТФ се изразходва най-интензивно в активно работещите органи на тялото: черен дроб, мускули, мозък. Не напразно известният минералог, един от основателите на науката за геохимията, академик А. Е. Ферсман нарече фосфора „елементът на живота и мисълта“.
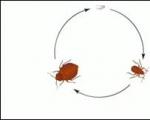
Както беше посочено, фосфорът съществува в природата под формата на съединения, открити в почвата (или разтворен в естествени води). Фосфорът се извлича от почвата от растенията, а животните получават фосфор от растителна храна. След смъртта на растителни и животински организми фосфорът се връща обратно в почвата. Така протича кръговратът на фосфора в природата (фиг. 36).
Приложение на фосфора и неговите съединения
. Червеният фосфор се използва за производство на кибрит и фосфорна киселина, която от своя страна се използва за производство на фосфатни торове и фуражни добавки за добитък. Освен това фосфорът се използва за производството на пестициди (помнете кутии с дихлорвос, хлорофос и др.). 
Откриване на фосфора
. Фосфорът е открит от немския алхимик Г. Бранд през 1669 г. и е получил името си заради способността си да свети в тъмното (гръцки фосфор - светещ).
1. Алотропия на фосфора: бял фосфор, червен фосфор.
2. Свойства на фосфора: образуване на фосфиди, фосфин, фосфорен оксид (V).
3. Фосфорна киселина и три серии нейни соли: фосфати, хидрогенфосфати и дихидрогенфосфати.
4. Биологично значение на фосфора (калциев фосфат, АТФ, ДНК и РНК).
5. Приложение на фосфора и неговите съединения.
Напишете формулите на три вида соли на натриева и фосфорна киселина, назовете ги и запишете уравненията за тяхната дисоциация.
Напишете уравненията на реакцията, които могат да се използват за извършване на следните трансформации:
P -> Mg3P2 -> PH3 -> P205 -> H3P04 -> Ca3(P04)2
Съдържание на урока бележки към уроцитеподдържаща рамка презентация урок методи ускорение интерактивни технологии Практикувайте задачи и упражнения самопроверка работилници, обучения, казуси, куестове домашна работа въпроси за дискусия риторични въпроси от ученици Илюстрации аудио, видео клипове и мултимедияснимки, картинки, графики, таблици, диаграми, хумор, анекдоти, вицове, комикси, притчи, поговорки, кръстословици, цитати Добавки резюметастатии трикове за любознателните ясли учебници основен и допълнителен речник на термините други Подобряване на учебниците и уроцитекоригиране на грешки в учебникаактуализиране на фрагмент в учебник, елементи на иновация в урока, замяна на остарели знания с нови Само за учители перфектни уроцикалендарен план за годината методически препоръки програми за дискусии Интегрирани уроциФосфор и неговите съединения
Въведение
Глава I. Фосфорът като елемент и като просто вещество
1.1. Фосфор в природата
1.2. Физични свойства
1.3. Химични свойства
1.4. Касова бележка
1.5. Приложение
Глава II. Фосфорни съединения
2.1. Оксиди
2.2. Киселини и техните соли
2.3. Фосфин
Глава III. Фосфорни торове
Заключение
Библиография
Въведение
Фосфорът (лат. Phosphorus) P е химичен елемент от V група на периодичната система на Менделеев, атомен номер 15, атомна маса 30,973762(4). Нека разгледаме структурата на фосфорния атом. Външното енергийно ниво на фосфорния атом съдържа пет електрона. Графично изглежда така:1с 2 2с 2 2стр 6 3с 2 3стр 3 3д 0

През 1699 г. алхимикът от Хамбург Х. Бранд, в търсене на „философски камък“, за който се предполага, че може да превръща неблагородните метали в злато, при изпаряване на урината с въглища и пясък, изолира бяло восъчно вещество, което може да свети.
Името "фосфор" идва от гръцки. “phos” – светлина и “phoros” – носител. В Русия терминът „фосфор“ е въведен през 1746 г. от М.В. Ломоносов.
Основните фосфорни съединения включват оксиди, киселини и техните соли (фосфати, дихидрогенфосфати, хидрогенфосфати, фосфиди, фосфити).
В торовете се съдържат много фосфорсъдържащи вещества. Такива торове се наричат фосфорни торове.
Глава аз Фосфорът като елемент и като просто вещество
1.1 Фосфорът в природата
Фосфорът е един от често срещаните елементи. Общото съдържание в земната кора е около 0,08%. Поради лесното си окисление, фосфорът се среща в природата само под формата на съединения. Основните фосфорни минерали са фосфорити и апатити, от последните най-често срещаният е флуорапатит 3Ca 3 (PO 4) 2 CaF 2. Фосфоритите са широко разпространени в Урал, Поволжието, Сибир, Казахстан, Естония и Беларус. Най-големите находища на апатит се намират на полуостров Кола.
Фосфорът е необходим елемент за живите организми. Той присъства в костите, мускулите, мозъчната тъкан и нервите. Молекулите на АТФ са изградени от фосфор – аденозинтрифосфорна киселина (АТФ е колектор и носител на енергия). Тялото на възрастен човек съдържа средно около 4,5 kg фосфор, главно в комбинация с калций.
Фосфорът се намира и в растенията.
Естественият фосфор се състои само от един стабилен изотоп 31 R. Днес са известни шест радиоактивни изотопа на фосфора.
1.2 Физични свойства
Фосфорът има няколко алотропни модификации - бял, червен, черен, кафяв, виолетов фосфор и др. Най-изследвани са първите три от тях.
Бял фосфор- безцветно кристално вещество с жълтеникав оттенък, което свети на тъмно. Плътността му е 1,83 g/cm3. Неразтворим във вода, разтворим във въглероден дисулфид. Има характерна миризма на чесън. Точка на топене 44°C, температура на самозапалване 40°C. За да се предпази белият фосфор от окисление, той се съхранява под вода на тъмно (на светлина се превръща в червен фосфор). На студено белият фосфор е крехък, при температура над 15°C става мек и може да се реже с нож.
Молекулите на белия фосфор имат кристална решетка, в чиито възли има молекули P 4, оформени като тетраедър.
Всеки фосфорен атом е свързан с три σ връзки с останалите три атома.
Белият фосфор е отровен и причинява трудно заздравяващи изгаряния.
Червен фосфор– прахообразно вещество с тъмночервен цвят, без мирис, не се разтваря във вода и въглероден дисулфид и не свети. Температура на запалване 260°C, плътност 2,3 g/cm 3 . Червеният фосфор е смес от няколко алотропни модификации, които се различават по цвят (от червено до виолетово). Свойствата на червения фосфор зависят от условията на неговото производство. Не е отровен.
Черен фосфорПрилича на графит, усеща се мазен на допир и има полупроводникови свойства. Плътност 2,7 g/cm3.
Червеният и черният фосфор имат атомна кристална решетка.
1.3 Химични свойства
Фосфорът е неметал. В съединенията обикновено проявява степен на окисление +5, по-рядко - +3 и -3 (само във фосфидите).
Реакциите с бял фосфор са по-лесни, отколкото с червения фосфор.
I. Взаимодействие с прости вещества.
1. Взаимодействие с халогени:
2P + 3Cl 2 = 2PCl 3 (фосфорен (III) хлорид),
PCl 3 + Cl 2 = PCl 5 (фосфорен (V) хлорид).
2. Взаимодействие с неметали:
2P + 3S = P 2 S 3 (фосфорен (III) сулфид.
3. Взаимодействие с метали:
2P + 3Ca = Ca 3 P 2 (калциев фосфид).
4. Взаимодействие с кислород:
4P + 5O 2 = 2P 2 O 5 (фосфорен (V) оксид, фосфорен анхидрид).
II. Взаимодействие със сложни вещества.
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO.
1.4 Получаване
Фосфорът се получава от натрошени фосфорити и апатити, като последните се смесват с въглища и пясък и се калцинират в пещи при 1500 ° C:
2Ca 3 (PO 4) 2 + 10C + 6SiO 2
6CaSiO3 + P4 + 10CO.Фосфорът се отделя под формата на пара, която кондензира в приемника под вода, образувайки бял фосфор.
При нагряване до 250-300°C без достъп на въздух белият фосфор се превръща в червен.
Черният фосфор се получава чрез продължително нагряване на бял фосфор при много високо налягане (200°C и 1200 MPa).
1.5 Приложение
Червеният фосфор се използва при производството на кибрит (вижте снимката). Той е част от сместа, нанесена върху страничната повърхност на кибритената кутия. Основният компонент на кибритената глава е бертолетовата сол KClO 3 . Поради триенето на кибритената глава върху смазката, фосфорните частици във въздуха се запалват. В резултат на реакцията на окисление на фосфора се отделя топлина, което води до разлагането на бертолетовата сол.
KCl+.
Полученият кислород помага за запалването на кибритената глава.
Фосфорът се използва в металургията. Използва се за производство на проводници и е компонент на някои метални материали, като калаен бронз.
Фосфорът се използва и при производството на фосфорна киселина и пестициди (дихлорвос, хлорофос и др.).
Белият фосфор се използва за създаване на димни завеси, тъй като при изгарянето му се образува бял дим.
Глава II . Фосфорни съединения
2.1 Оксиди
Фосфорът образува няколко оксида. Най-важните от тях са фосфорен оксид (V) P 4 O 10 и фосфорен оксид (III) P 4 O 6. Често техните формули се записват в опростена форма - P 2 O 5 и P 2 O 3. Структурата на тези оксиди запазва тетраедричната подредба на фосфорните атоми.
Фосфорен оксид(III) P 4 O 6 е восъчна кристална маса, която се топи при 22,5 ° C и се превръща в безцветна течност. Отровни.
Когато се разтвори в студена вода, образува фосфорна киселина:
P 4 O 6 + 6H 2 O = 4H 3 PO 3,
а при взаимодействие с алкали - съответните соли (фосфити).
Силен редуциращ агент. При взаимодействие с кислорода се окислява до P 4 O 10.
Фосфорният (III) оксид се получава чрез окисление на бял фосфор в отсъствието на кислород.
Фосфорен оксид(V) P 4 O 10 – бял кристален прах. Температура на сублимация 36°C. Той има няколко модификации, една от които (така наречената летлива) има състав P 4 O 10. Кристалната решетка на тази модификация е съставена от P 4 O 10 молекули, свързани една с друга чрез слаби междумолекулни сили, които лесно се разрушават при нагряване. Оттук и нестабилността на този сорт. Други модификации са полимерни. Те са образувани от безкрайни слоеве от PO 4 тетраедри.
Когато P 4 O 10 взаимодейства с вода, се образува фосфорна киселина:
P 4 O 10 + 6H 2 O = 4H 3 PO 4.
Като киселинен оксид, P 4 O 10 реагира с основни оксиди и хидроксиди.
Образува се при високотемпературно окисление на фосфор в излишък на кислород (сух въздух).
Поради изключителната си хигроскопичност, фосфорният (V) оксид се използва в лабораторни и индустриални технологии като изсушаващ и дехидратиращ агент. По своето изсушаващо действие превъзхожда всички други вещества. Химически свързаната вода се отстранява от безводната перхлорна киселина, за да се образува нейният анхидрид:
4HClO4 + P4O10 = (HPO3)4 + 2Cl2O7.
2.2 Киселини и техните соли
а) Фосфорна киселина H3PO3. Безводната фосфорна киселина H 3 PO 3 образува кристали с плътност 1,65 g/cm 3, топящи се при 74°C.
Структурна формула:
.Когато безводният H 3 PO 3 се нагрява, възниква реакция на диспропорциониране (автоокисление-самовъзстановяване):
4H3PO3 = PH3 + 3H3PO4.
Соли на фосфорна киселина – фосфити. Например K 3 PO 3 (калиев фосфит) или Mg 3 (PO 3) 2 (магнезиев фосфит).
Фосфорната киселина H 3 PO 3 се получава чрез разтваряне на фосфорен (III) оксид във вода или хидролиза на фосфорен (III) хлорид PCl 3:
РCl 3 + 3H 2 O = H 3 PO 3 + 3HCl.
б) Фосфорна киселина (ортофосфорна киселина) H 3 PO 4 .
Безводната фосфорна киселина изглежда като леки прозрачни кристали, които дифундират във въздуха при стайна температура. Точка на топене 42,35°C. Фосфорната киселина образува разтвори с всякаква концентрация с вода.
Въведение
Глава I. Фосфорът като елемент и като просто вещество
1.1. Фосфор в природата
1.2. Физични свойства
1.3. Химични свойства
1.4. Касова бележка
1.5. Приложение
Глава II. Фосфорни съединения
2.1. Оксиди
2.2. Киселини и техните соли
2.3. Фосфин
Глава III. Фосфорни торове
Заключение
Библиография
Въведение
Фосфорът (лат. Phosphorus) P е химичен елемент от V група на периодичната система на Менделеев, атомен номер 15, атомна маса 30,973762(4). Нека разгледаме структурата на фосфорния атом. Външното енергийно ниво на фосфорния атом съдържа пет електрона. Графично изглежда така:
1s22s22p63s23p33d0

През 1699 г. алхимикът от Хамбург Х. Бранд, в търсене на „философски камък“, за който се предполага, че може да превръща неблагородните метали в злато, при изпаряване на урината с въглища и пясък, изолира бяло восъчно вещество, което може да свети.
Името "фосфор" идва от гръцки. “phos” – светлина и “phoros” – носител. В Русия терминът „фосфор“ е въведен през 1746 г. от М.В. Ломоносов.
Основните фосфорни съединения включват оксиди, киселини и техните соли (фосфати, дихидрогенфосфати, хидрогенфосфати, фосфиди, фосфити).
В торовете се съдържат много фосфорсъдържащи вещества. Такива торове се наричат фосфорни торове.
ГлаваазФосфорът като елемент и като просто вещество
Фосфор в природата
Фосфорът е един от често срещаните елементи. Общото съдържание в земната кора е около 0,08%. Поради лесното си окисление, фосфорът се среща в природата само под формата на съединения. Основните фосфорни минерали са фосфорити и апатити, от последните най-разпространен е флуорапатит 3Ca3(PO4)2 CaF2. Фосфоритите са широко разпространени в Урал, Поволжието, Сибир, Казахстан, Естония и Беларус. Най-големите находища на апатит се намират на полуостров Кола.
Фосфорът е необходим елемент за живите организми. Той присъства в костите, мускулите, мозъчната тъкан и нервите. Молекулите на АТФ са изградени от фосфор – аденозинтрифосфорна киселина (АТФ е колектор и носител на енергия). Тялото на възрастен човек съдържа средно около 4,5 kg фосфор, главно в комбинация с калций.
Фосфорът се намира и в растенията.
Естественият фосфор се състои само от един стабилен изотоп, 31P. Днес са известни шест радиоактивни изотопа на фосфора.
Физични свойства
Фосфорът има няколко алотропни модификации - бял, червен, черен, кафяв, виолетов фосфор и др. Най-изследвани са първите три от тях.
Белият фосфор е безцветно кристално вещество с жълтеникав оттенък, което свети на тъмно. Плътността му е 1,83 g/cm3. Неразтворим във вода, разтворим във въглероден дисулфид. Има характерна миризма на чесън. Точка на топене 44°C, температура на самозапалване 40°C. За да се предпази белият фосфор от окисление, той се съхранява под вода на тъмно (на светлина се превръща в червен фосфор). На студено белият фосфор е крехък, при температура над 15°C става мек и може да се реже с нож.
Молекулите на белия фосфор имат кристална решетка, в чиито възли се намират молекули Р4, оформени като тетраедър.
Всеки фосфорен атом е свързан с три σ връзки с останалите три атома.
Белият фосфор е отровен и причинява трудно заздравяващи изгаряния.
Червеният фосфор е тъмночервено прахообразно вещество без мирис, което не се разтваря във вода или въглероден дисулфид и не свети. Температура на запалване 260°C, плътност 2,3 g/cm3. Червеният фосфор е смес от няколко алотропни модификации, които се различават по цвят (от червено до виолетово). Свойствата на червения фосфор зависят от условията на неговото производство. Не е отровен.
Черният фосфор прилича на външен вид на графит, мазен е на допир и има полупроводникови свойства. Плътност 2,7 g/cm3.
Червеният и черният фосфор имат атомна кристална решетка.
Химични свойства
Фосфорът е неметал. В съединенията обикновено проявява степен на окисление +5, по-рядко - +3 и -3 (само във фосфиди).
Реакциите с бял фосфор са по-лесни, отколкото с червения фосфор.
I. Взаимодействие с прости вещества.
Взаимодействие с халогени:
2P + 3Cl2 = 2PCl3 (фосфорен (III) хлорид),
PCl3 + Cl2 = PCl5 (фосфорен (V) хлорид).
Взаимодействие с неметали:
2P + 3S = P2S3 (фосфорен (III) сулфид.
Взаимодействие с метали:
2P + 3Ca = Ca3P2 (калциев фосфид).
Взаимодействие с кислород:
4P + 5O2 = 2P2O5 (фосфорен (V) оксид, фосфорен анхидрид).
II. Взаимодействие със сложни вещества.
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO.
Касова бележка
Фосфорът се получава от натрошени фосфорити и апатити, като последните се смесват с въглища и пясък и се калцинират в пещи при 1500 ° C:
2Ca3(PO4)2 + 10C + 6SiO2  6CaSiO3 + P4 + 10CO.
6CaSiO3 + P4 + 10CO.
Фосфорът се отделя под формата на пара, която кондензира в приемника под вода, образувайки бял фосфор.
При нагряване до 250-300°C без достъп на въздух белият фосфор се превръща в червен.
Черният фосфор се получава чрез продължително нагряване на бял фосфор при много високо налягане (200°C и 1200 MPa).
Приложение
Червеният фосфор се използва при производството на кибрит (вижте снимката). Той е част от сместа, нанесена върху страничната повърхност на кибритената кутия. Основният компонент на кибритената глава е бертолетовата сол KClO3. Поради триенето на кибритената глава върху смазката, фосфорните частици във въздуха се запалват. В резултат на реакцията на окисление на фосфора се отделя топлина, което води до разлагането на бертолетовата сол.
KClO3  KCl+.
KCl+.

Полученият кислород помага за запалването на кибритената глава.
Фосфорът се използва в металургията. Използва се за производство на проводници и е компонент на някои метални материали, като калаен бронз.
Фосфорът се използва и при производството на фосфорна киселина и пестициди (дихлорвос, хлорофос и др.).
Белият фосфор се използва за създаване на димни завеси, тъй като при изгарянето му се образува бял дим.
ГлаваII. Фосфорни съединения
2.1 Оксиди
Фосфорът образува няколко оксида. Най-важните от тях са фосфорен оксид (V) P4O10 и фосфорен оксид (III) P4O6. Често техните формули са написани в опростена форма - P2O5 и P2O3. Структурата на тези оксиди запазва тетраедричната подредба на фосфорните атоми.
Фосфорният (III) оксид P4O6 е восъчна кристална маса, която се топи при 22,5°C и се превръща в безцветна течност. Отровни.
Когато се разтвори в студена вода, образува фосфорна киселина:
P4O6 + 6H2O = 4H3PO3,
а при взаимодействие с алкали - съответните соли (фосфити).
Силен редуциращ агент. При взаимодействие с кислорода се окислява до P4O10.
Фосфорният (III) оксид се получава чрез окисление на бял фосфор в отсъствието на кислород.
Фосфорен (V) оксид P4O10 е бял кристален прах. Температура на сублимация 36°C. Има няколко модификации, една от които (т.нар. летлива) има състав P4O10. Кристалната решетка на тази модификация е съставена от молекули P4O10, свързани една с друга чрез слаби междумолекулни сили, които лесно се разрушават при нагряване. Оттук и нестабилността на този сорт. Други модификации са полимерни. Те са образувани от безкрайни слоеве тетраедри на PO4.
Когато P4O10 взаимодейства с вода, се образува фосфорна киселина:
P4O10 + 6H2O = 4H3PO4.
Тъй като е киселинен оксид, P4O10 реагира с основни оксиди и хидроксиди.
Образува се при високотемпературно окисление на фосфор в излишък на кислород (сух въздух).
Поради изключителната си хигроскопичност, фосфорният (V) оксид се използва в лабораторни и индустриални технологии като изсушаващ и дехидратиращ агент. По своето изсушаващо действие превъзхожда всички други вещества. Химически свързаната вода се отстранява от безводната перхлорна киселина, за да се образува нейният анхидрид:
4HClO4 + P4O10 = (HPO3)4 + 2Cl2O7.
2.2 Киселини и техните соли
а) Фосфорна киселина H3PO3. Безводната фосфорна киселина H3PO3 образува кристали с плътност 1,65 g/cm3, топящи се при 74°C.
Структурна формула:
 .
.
При нагряване на безводен H3PO3 възниква реакция на диспропорциониране (автоокисление-саморедукция):
4H3PO3 = PH3 + 3H3PO4.
Соли на фосфорната киселина - фосфити. Например K3PO3 (калиев фосфит) или Mg3(PO3)2 (магнезиев фосфит).
Фосфорната киселина H3PO3 се получава чрез разтваряне на фосфорен (III) оксид във вода или хидролиза на фосфорен (III) хлорид PCl3:
РCl3 + 3H2O = H3PO3 + 3HCl.
б) Фосфорна киселина (ортофосфорна киселина) H3PO4.
Безводната фосфорна киселина изглежда като леки прозрачни кристали, които дифундират във въздуха при стайна температура. Точка на топене 42,35°C. Фосфорната киселина образува разтвори с всякаква концентрация с вода.
Фосфорната киселина има следната структурна формула:
 .
.
Фосфорната киселина реагира с метали, разположени в серия от стандартни електродни потенциали до водород, с основни оксиди, с основи и със соли на слаби киселини.
В лабораторията фосфорната киселина се получава чрез окисляване на фосфор с 30% азотна киселина:
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO.
В промишлеността фосфорната киселина се произвежда по два начина: екстракция и термично. Методът на екстракция се основава на обработката на натрошени естествени фосфати със сярна киселина:
Ca3(PO4)2 + 3H2SO4 = 2H3PO4 + 3CaSO4↓.
След това фосфорната киселина се филтрува и се концентрира чрез изпаряване.
Термичният метод се състои в редуциране на естествените фосфати до свободен фосфор, последвано от изгарянето му до P4O10 и разтварянето на последния във вода. Фосфорната киселина, произведена по този метод, се характеризира с по-висока чистота и повишена концентрация (до 80% от теглото).
Фосфорната киселина се използва за производство на торове, за приготвяне на реактиви, органични вещества и за създаване на защитни покрития върху метали. Пречистената фосфорна киселина е необходима за приготвянето на фармацевтични продукти и фуражни концентрати.
Фосфорната киселина не е силна киселина. Като триосновна киселина, тя се дисоциира стъпаловидно във воден разтвор. Дисоциацията е по-лесна на първия етап.
H3PO4  H+ +
H+ +  (дихидроген фосфатен йон);
(дихидроген фосфатен йон);

 H+ +
H+ +  (хидрогенфосфатен йон);
(хидрогенфосфатен йон);

 H+ +
H+ +  (фосфатен йон).
(фосфатен йон).
Общо йонно уравнение за дисоциацията на фосфорна киселина:
H3PO4  3H+ +
3H+ +  .
.
Фосфорната киселина образува три серии соли:
а) K3PO4, Ca3(PO4)2 – тризаместени или фосфати;
б) K2HPO4, CaHPO4 – двузаместени или хидрофосфати;
в) KH2PO4, Ca(H2PO4)2 – монозаместени или дихидрогенфосфати.
Еднозаместените фосфати са киселинни, двуосновните фосфати са слабо алкални, а триосновните фосфати са алкални.
Всички алкални метали и амониеви фосфати са разтворими във вода. От калциевите соли на фосфорната киселина само калциевият дихидрогенфосфат се разтваря във вода. Калциевият хидрогенфосфат и калциевият фосфат са разтворими в органични киселини.
При нагряване фосфорната киселина първо губи вода - разтворителя, след което започва дехидратация на фосфорната киселина и се образува дифосфорна киселина:
2H3PO4 = H4P2O7 + H2O.
Значителна част от фосфорната киселина се превръща в дифосфорна киселина при температура около 260°C.
в) Фосфорна киселина (хипофосфорна киселина) H4P2O6.
 .
.
H4P2O6 е четириосновна киселина със средна сила. По време на съхранение хипофосфорната киселина постепенно се разлага. Когато разтворите му се нагреят, той се превръща в H3PO4 и H3PO3.
Образува се при бавното окисляване на H3PO3 във въздуха или при окисляването на белия фосфор във влажен въздух.
г) Хипофосфорна киселина (хипофосфорна киселина) H3PO2. Тази киселина е едноосновна и силна. Хипофосфорната киселина има следната структурна формула:
 .
.
Хипофосфитите - соли на хипофосфорната киселина - обикновено са силно разтворими във вода.
Хипофосфитите и H3PO2 са енергийни редуциращи агенти (особено в кисела среда). Тяхната ценна характеристика е способността да редуцират разтворените соли на някои метали (Ni, Cu и др.) до свободен метал:
2Ni2+ +  + 2H2O → Ni0 +
+ 2H2O → Ni0 +  + 6H+.
+ 6H+.
Хипофосфорната киселина се получава чрез разлагане на калциеви или бариеви хипофосфити със сярна киселина:
Ba(H2PO2)2 + H2SO4 = 2H3PO2 + BaSO4↓.
Хипофосфитите се образуват при кипене на бял фосфор в суспензии на калциев или бариев хидроксид.
2P4 (бял) + 3Ba(OH)2 + 6H2O = 2PH3 + 3Ba(H2PO2)2.
2.3 Фосфин
Фосфин PH3 - съединение на фосфор с водород - безцветен газ с остър, неприятен мирис на чесън, силно разтворим във вода (не реагира химически с нея) и е много токсичен. На въздух чистият и сух фосфин се запалва при нагряване над 100-140°C. Ако фосфинът съдържа примеси на дифосфин P2H4, той спонтанно се запалва във въздуха.
При взаимодействие с някои силни киселини фосфинът образува фосфониеви соли, например:
PH3 + HCl = PH4Cl (фосфониев хлорид).
Структурата на фосфониевия катион [PH4]+ е подобна на структурата на амониевия катион +.
Водата разлага фосфониевите соли до образуване на фосфин и халогеноводород.
Фосфинът може да се получи чрез взаимодействие на фосфиди с вода:
Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3.
И едно последно нещо. При взаимодействието на фосфора с металите се образуват соли - фосфиди. Например Ca3P2 (калциев фосфид), Mg3P2 (магнезиев фосфид).
Глава III Фосфорни торове
Фосфорните съединения, подобно на азота, постоянно претърпяват трансформации в природата - цикълът на фосфор се среща в природата. Растенията извличат фосфати от почвата и ги превръщат в сложни фосфорсъдържащи органични вещества. Тези вещества влизат в тялото на животните с растителна храна - образуването на протеинови вещества в нервната и мускулната тъкан, калциеви фосфати в костите и др. След смъртта на животните и растенията, фосфорсъдържащите съединения се разлагат под действието на микроорганизми. В резултат на това се образуват фосфати. Така цикълът, представен от диаграмата, е завършен:
P (живи организми)  P (почва).
P (почва).
Този цикъл се нарушава, когато фосфорните съединения се отстранят от добивите. Липсата на фосфор в почвата практически не се попълва естествено. Ето защо е необходимо да се прилагат фосфорни торове.
Както знаете, минералните торове могат да бъдат прости и сложни. Простите торове включват торове, съдържащи един хранителен елемент. Комплексните торове съдържат няколко хранителни вещества.
Как се произвеждат фосфатни торове в промишлеността? Естествените фосфати не се разтварят във вода и са слабо разтворими в почвени разтвори и се абсорбират слабо от растенията. Преработката на естествени фосфати във водоразтворими съединения е задача за химическата промишленост. Съдържанието на хранителния елемент фосфор в тора се оценява по съдържанието на фосфорен оксид (V) P2O5.
Основният компонент на фосфатните торове е калциев дихидроген или хидрогенфосфат. Фосфорът е част от много органични съединения в растенията. Храненето с фосфор регулира растежа и развитието на растенията. Най-често срещаните фосфорни торове включват:
1. Фосфоритно брашно - фин бял прах. Съдържа 18-26% P2O5.
Получава се чрез смилане на фосфорити Ca3(PO4)2.
Фосфоритното брашно може да се абсорбира само върху подзолисти и торфени почви, съдържащи органични киселини.
2. Прост суперфосфат - сив финозърнест прах. Съдържа до 20% P2O5.
Получава се чрез взаимодействие на естествен фосфат със сярна киселина:
Ca3(PO4)2 + 2H2SO4 = Ca(H2PO4)2 + 2CaSO4.
суперфосфат
В този случай се получава смес от соли Ca(H2PO4)2 и CaSO4, която се усвоява добре от растенията във всяка почва.
3. Двоен суперфосфат (цвят и външен вид, подобни на обикновен суперфосфат).
Получава се чрез въздействие върху естествения фосфат с фосфорна киселина:
Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2.
В сравнение с обикновения суперфосфат, той не съдържа CaSO4 и е много по-концентриран тор (съдържа до 50% P2O5).
4. Утайка – съдържа 35-40% P2O5.
Получава се чрез неутрализиране на фосфорна киселина с разтвор на калциев хидроксид:
H3PO4 + Ca(OH)2 = CaHPO4 2H2O.
Използва се на кисели почви.
5. Костно брашно. Получава се чрез обработка на костите на домашни животни и съдържа Ca3(PO4)2.
6. Амофос е комплексен тор, съдържащ азот (до 15% K) и фосфор (до 58% P2O5) под формата на NH4H2PO4 и (NH4)2HPO4. Получава се чрез неутрализиране на фосфорна киселина с амоняк.
Заключение
И в заключение бих искал да кажа биологичното значение на фосфора. Фосфорът е неразделна част от тъканите на човешки, животински и растителни организми. В човешкото тяло повечето фосфор е свързан с калций. За да изгради скелет, детето се нуждае от толкова фосфор, колкото и калций. Освен в костите, фосфорът се намира в нервната и мозъчната тъкан, кръвта и млякото. В растенията, както и в животните, фосфорът е част от протеините.
От фосфора, постъпващ в човешкото тяло с храната, предимно яйца, месо, мляко и хляб, се изгражда АТФ - аденозинтрифосфорна киселина, която служи като колектор и носител на енергия, както и нуклеиновите киселини - ДНК и РНК, които пренасят наследствени свойства на тялото. АТФ се изразходва най-интензивно в активно работещите органи на тялото: черния дроб, мускулите и мозъка. Не напразно известният минералог, един от основателите на науката за геохимията, академик А. Е. Ферсман нарече фосфора „елементът на живота и мисълта“.
Както беше посочено, фосфорът съществува в природата под формата на съединения, открити в почвата (или разтворен в естествени води). Фосфорът се извлича от почвата от растенията, а животните получават фосфор от растителна храна. След смъртта на растителни и животински организми фосфорът се връща обратно в почвата. Така протича цикълът на фосфора в природата.
Библиография:
Ахметов Н.С. Химия 9 клас: учебник. за общо образование учебник заведения. – 2-ро изд. – М.: Образование, 1999. – 175 с.: ил.
Габриелян О.С. Химия 9 клас: учебник. за общо образование учебник заведения. – 4-то изд. – М.: Дропла, 2001. – 224 с.: ил.
Габриелян О.С. Химия 8-9 клас: метод. надбавка. – 4-то изд. – М.: Дропла, 2001. – 128 с.
Ерошин Д.П., Шишкин Е.А. Методи за решаване на задачи по химия: учебник. надбавка. – М.: Образование, 1989. – 176 с.: ил.
Кременчугская М. Химия: Наръчник за ученици. – М.: Филол. Общество "WORD": LLC "AST Publishing House", 2001. - 478 с.
Крицман В.А. Христоматия по неорганична химия. – М.: Образование, 1986. – 273 с.
Подобни резюмета:
Арсен (лат. Arsenicum), As, химичен елемент от V група на периодичната система на Менделеев, атомен номер 33, атомна маса 74.9216; стоманеносиви кристали. Елементът се състои от един стабилен изотоп
Катедра по химия на Сургутския държавен университет РЕЗЮМЕ
При нагряване постепенно се превръща в метафосфорна киселина:
бифосфор
киселина
2. При излагане на разтвор на сребърен (I) нитрат се появява жълта утайка:
жълто
утайка

3. Ортофосфорната киселина играе важна роля в живота на животните и растенията.Неговите остатъци са част от аденозинтрифосфорната киселина АТФ.
Когато АТФ се разпадне, се освобождава голямо количество енергия.
Ортофосфати. Фосфорната киселина образува три серии соли. Ако обозначим металните атоми с буквите Me, тогава можем да изобразим в общ вид състава на неговите соли (Таблица 3).
Таблица 3
Химични формули на ортофосфати, съдържащи метали
|
едновалентен |
двувалентен |
тривалентен |
|
Ортофосфати Аз 3 (PO 4) 2 |
Аз 3 PO 4 |
|
|
|
Водородни ортофосфати |
Аз 2 (NRO 4) 3 |
|
|
Дихидроген ортофосфати Me(H 2 PO 4) 2 |
Me(H 2 PO 4) 3 |
Вместо едновалентен метал, съставът на ортофосфатните молекули може да включва амониева група: (NH 4) 3 PO 4 - амониев ортофосфат;
(NH 4) 2 HPO 4 - амониев хидроген ортофосфат; NH 4 H 2 PO 4 – амониев дихидроген ортофосфат.
Калциевите и амониевите ортофосфати и хидроортофосфати се използват широко като торове, а натриевият ортофосфат и натриевият хидрогенортофосфат се използват за утаяване на калциеви соли от водата.
Фосфор в човешкото тяло
В човешко тяло с тегло 70 кг. Съдържа около 780 g фосфор. Фосфорът присъства под формата на калциеви фосфати в човешки и животински кости. Също така е част от протеини, фосфолипиди и нуклеинови киселини; Фосфорните съединения участват в енергийния метаболизъм (аденезинтрифосфорна киселина, АТФ). Дневната нужда на човешкия организъм от фосфор е 1,2 г. Основното количество от него приемаме с млякото и хляба (в 100 г хляб се съдържат приблизително 200 мг фосфор). Най-богати на фосфор са рибата, бобът и някои видове сирена.
Интересното е, че за правилното хранене е необходимо да се поддържа баланс между количеството консумиран фосфор и калций: оптималното съотношение в тези хранителни елементи е 1,51. Излишъкът от храни, богати на фосфор, води до измиване на калций от костите, а при излишък на калций се развива уролитиаза.
Съвпадения
Горящата повърхност на кибритена кутия е покрита със смес от червен фосфор и стъклен прах. Съставът на кибритената глава включва окислители (PbO 2, KСlO 3, BaCrO 4) и редуциращи агенти (S, Sb 2 S 3). При триене от повърхността на запалването сместа, нанесена върху кибрита, се запалва:Първите фосфорни кибрити - с глава от бял фосфор - са създадени едва през 1827 г. Такива кибрити се запалват при триене в някаква повърхност, което често води до пожари. Освен това белият фосфор е много отровен. Описани са случаи на отравяне с фосфорни кибритени клечки, както поради невнимателно боравене, така и с цел самоубийство: за това беше достатъчно да изядете няколко кибритени глави. Ето защо фосфорните кибрити бяха заменени от безопасни, които ни служат вярно и до днес. Индустриалното производство на безопасни кибрит започва в Швеция през 60-те години. XIX век.
Фосфорни торове
Минералните торове са източник на различни хранителни вещества за растенията и свойствата на почвата, предимно азот, фосфор и калий, а след това калций, магнезий, сяра, желязо.
Фосфорът е част от много органични съединения в растенията. Храненето с фосфор регулира растежа и развитието на растенията.
Суровините за производството на фосфорни торове, фосфор и всички фосфорни съединения са апатитни и фосфатни руди. Съставът на апатитите най-често се изразява с формулата Ca 5 (PO 4) 3 F (флуорапатит). Фосфоритите се различават от флуорапатитите по това, че вместо F - йони съдържат OH - или  . Фосфоритите обикновено съдържат повече примеси от флуорапатита.
. Фосфоритите обикновено съдържат повече примеси от флуорапатита.
В предреволюционна Русия са били известни и разработени само тънки находища на нискокачествени фосфорити. Следователно събитие от огромно национално икономическо значение беше откриването на находище на апатит на Колския полуостров в планината Хибини през 20-те години на миналия век. Тук е изградена голяма преработвателна фабрика, която разделя добитата скала в концентрат с високо съдържание на фосфор и примеси - „нефелинови отпадъци“, използвани за производство на алуминий, сода, поташ и цимент.
В Южен Казахстан, в планината Каратау, са открити мощни находища на фосфорити.
Най-евтиният фосфорен тор е фино смлян фосфорит - фосфатна скала. Фосфорът се съдържа в него под формата на неразтворим във вода калциев фосфат Ca 3 (PO 4) 2. Следователно фосфоритите не се усвояват от всички растения и не от всички почви. По-голямата част от добитите фосфорни руди се преработват по химически методи във вещества, достъпни за всички растения на всяка почва. Това са водоразтворими калциеви фосфати:
Двоен суперфосфат(цвят и външен вид, подобни на обикновен суперфосфат - сив финозърнест прах).
Получава се чрез въздействие върху естествения фосфат с фосфорна киселина:
В сравнение с обикновения суперфосфат, той не съдържа CaSO 4 и е значително концентриран тор (съдържа до 50% P 2 O 5).
Утайка– съдържа 35-40% P 2 O 5.
Получава се чрез неутрализиране на фосфорна киселина с разтвор на калциев хидроксид:
Използва се на кисели почви.
Амофос – комплекс тор, съдържащ азот (до 15% N) и фосфор (до 58% P 2 O 5) под формата на NH 4 H 2 PO 4 и (NH 4) 2 HPO 4. Получава се чрез неутрализиране на фосфорна киселина с амоняк.
Преди това, повече от 100 години, т.нар прост суперфосфат, който се образува от действието на сярна киселина върху естествен калциев фосфат:
В този случай относително по-малко сярна киселина реагира с калциев фосфат, отколкото при производството на фосфорна киселина от него. Резултатът е смес от калциев дихидроген фосфат и калциев сулфат. Това е тор с масова част на P 2 O 5 не по-висока от 20%. Сега простият суперфосфат се произвежда в сравнително малък мащаб в предварително построени инсталации.
Сложен състав. Съдържа P, Ca, Si, C, Fe и други елементи
Комплекс
Амофос
Амофоска
Нитроамофоска
Заключение
Стойност на фосфора
Производните на ортофосфорната киселина са много необходими не само за растенията, но и за животните. Костите, зъбите, черупките, ноктите, иглите и шиповете в повечето живи организми се състоят главно от калциев ортофосфат. В допълнение, ортофосфорната киселина, образувайки различни съединения с органични вещества, активно участва в метаболитните процеси на живия организъм с околната среда. В резултат на това производните на фосфора се намират в костите, мозъка, кръвта, мускулите и съединителната тъкан на хора и животни. Особено много ортофосфорна киселина има в състава на нервните (мозъчни) клетки, което позволи на A.E. Ферсман 1, известен геохимик, нарече фосфора „елементът на мисълта“. Намаляването на съдържанието на фосфорни съединения в храната или въвеждането им в несмилаема форма има много негативен ефект върху състоянието на тялото (заболяване на животните с рахит, анемия и др.).
Приложение на фосфор
Хранителната промишленост консумира много ортофосфорна киселина. Факт е, че разредената ортофосфорна киселина има много приятен вкус и малките й добавки към мармалади, лимонади и сиропи значително подобряват вкуса им. Някои соли на фосфорната киселина също имат това свойство. Калциевите хидрогенфосфати, например, отдавна се включват в бакпулверите, подобряващи вкуса на кифли и хляб.
Други индустриални приложения на ортофосфорната киселина също са интересни. Например, беше забелязано, че импрегнирането на дърво със самата киселина и нейните соли прави дървото незапалимо. На тази основа вече се произвеждат огнезащитни бои, незапалими плочи от фосфорно дърво, незапалим фосфатен пенопласт и други строителни материали.
Различни соли на фосфорната киселина се използват широко в много индустрии, в строителството, различни области на техниката, в комуналните услуги и бита, за защита от радиация, за омекотяване на вода, борба с котлен камък и производство на различни почистващи препарати.
Фосфорната киселина, кондензираните киселини и дехидратираните фосфати служат като катализатори в процесите на дехидратация, алкилиране и полимеризация на въглеводороди.
Органофосфорните съединения заемат специално място като екстрагенти, пластификатори, лубриканти, прахообразни добавки и абсорбенти в хладилните агрегати. Солите на киселинните алкилфосфати се използват като повърхностноактивни вещества, антифриз, специални торове, латексни антикоагуланти и др. Киселинните алкилфосфати се използват за екстракционна обработка на течности от уранова руда.
Списък на използваната литература:
F.G.Feldman, G.E.Rudzitis. ХИМИЯ. Учебник за 9 клас на общообразователните институции. – М., 5-то издание, ПРОСВЕЩЕНИЕ, 1997.
ХИМИЯ. Справочни материали. Под редакцията на Ю. Д. Третяков, - М., ОБРАЗОВАНИЕ, 1984.
ХИМИЯ. Наръчник за ученици, - М., 1995.
ХИМИЯ. Енциклопедия за деца. Том 17, AVANTA, 2000.
Weser W.-J., Фосфор и неговите съединения, прев. от английски, - М., 1963.
Интернет: http://school-sector.relarn.ru/nsm/chemistry/
1 Ферсман Александър Евгениевич, съветски геохимик и минералог, академик на Академията на науките на СССР (1919). Ученик на В. И. Вернадски.
Фосфор (P)- поради висока активност в свободно състояние не се среща в природата.
Електронна конфигурация 1S 2 2S 2 2P 6 3S 2 3P 3
Фосфорът е неметал (това, което преди се наричаше металоид) със средна активност. Външната орбита на фосфорния атом съдържа пет електрона, три от които са несдвоени. Следователно, той може да проявява валенции от 3-, 3+ и 5+.
За да може фосфорът да прояви валентност 5+, е необходимо някакво въздействие върху атома, което би превърнало двата сдвоени електрона от последната орбита в несдвоени.
Фосфорът често се нарича многостранен елемент. Наистина, при различни условия той се държи различно, проявявайки или окислителни, или редуциращи свойства. Универсалността на фосфора включва и способността му да съществува в няколко алотропни модификации.
Разпространение в природата
Фосфорът е широко разпространен в природата и съставлява 0,12% от земната кора. Влиза в състава на протеини от растителен и животински произход. Човешкият скелет съдържа приблизително 1400 г фосфор, мускулите - 130 г, мозъкът и нервите - 12 г. Фосфорът заема значителна част в химичния състав на растенията и затова е важен тор. Основните суровини за производството на торове са апатит CaF 2 Ch3Ca 3 (PO 4) 2 и фосфорити, чиято основа е калциев фосфат Ca 3 (PO 4) 2. Елементарният фосфор се получава чрез електротермична редукция при 1400-1600°C от фосфорити и апатити в присъствието на SiO2. Апатит се добива в Русия, Бразилия, Финландия и Швеция. Основен източник на фосфор е фосфатната руда, добивана в големи количества в САЩ, Мароко, Тунис, Алжир, Египет и Израел. Гуано, друг източник на фосфор, се добива във Филипините, Сейшелите, Кения и Намибия.
Най-важните алотропни модификации
Бял фосфор.Може би най-известната модификация на елемент № 15 е мекият, восъчен, бял или жълт фосфор. Бранд го открива и благодарение на свойствата си елементът получава името си: на гръцки „фосфор“ означава светещ, светещ. Молекулата на белия фосфор се състои от четири атома, подредени във формата на тетраедър. Плътност 1,83, точка на топене 44,1°C, точка на кипене 280°C, Белият фосфор е отровен, изключително реактивен и лесно се окислява. Разтворим във въглероден дисулфид, течен амоняк и SO 2, бензен, етер, летлив. Има остър мирис на чесън. Почти неразтворим във вода. Свети в тъмното.
Червен фосфор.При нагряване без достъп на въздух над 250°C белият фосфор се превръща в червен. Това вече е полимер, но не много подредена структура. Реактивността на червения фосфор е значително по-малка от тази на белия фосфор. Не свети на тъмно и не се разтваря в въглероден дисулфид. (Винаги съдържа малки количества бял фосфор, в резултат на което може да бъде отровен.). Плътността му е много по-голяма, структурата му е дребнокристална. Без мирис, червено-кафяв цвят. Атомната кристална решетка е много сложна, обикновено аморфна. Неразтворим във вода и органични разтворители. Стабилен. Физическите свойства зависят от метода на приготвяне.
Черен фосфор- полимерно вещество с метален блясък, подобно на графит, без мирис, мазно на допир. Неразтворим във вода и органични разтворители. Атомна кристална решетка, полупроводник. t°кипене= 453°С (сублимация), t°топене= 1000°C (при p=1.8 * 10 9 Pa), стабилен.


По-малко известни са други, още по-високомолекулни модификации на фосфора - виолетова и кафява, които се различават една от друга по молекулно тегло и степен на подреденост на макромолекулите. Тези модификации са лабораторна екзотика и за разлика от белия и червения фосфор все още не са намерили практическо приложение.

 2P 2 +5 O 5
2P 2 +5 O 5
 Бяла модификация на фосфора, в резултат на кондензацията на парите, има молекулна кристална решетка, в чиито възли са разположени молекули Р4 (фиг. 1). Поради слабостта на междумолекулните сили, белият фосфор е летлив, стопим, може да се реже с нож и се разтваря в неполярни разтворители, като въглероден дисулфид. Белият фосфор е много реактивно вещество. Реагира бурно с кислород, халогени, сяра и метали. Окисляването на фосфора във въздуха се придружава от нагряване и нажежаване. Следователно белият фосфор се съхранява под вода, с която не реагира. Белият фосфор е много токсичен.
Бяла модификация на фосфора, в резултат на кондензацията на парите, има молекулна кристална решетка, в чиито възли са разположени молекули Р4 (фиг. 1). Поради слабостта на междумолекулните сили, белият фосфор е летлив, стопим, може да се реже с нож и се разтваря в неполярни разтворители, като въглероден дисулфид. Белият фосфор е много реактивно вещество. Реагира бурно с кислород, халогени, сяра и метали. Окисляването на фосфора във въздуха се придружава от нагряване и нажежаване. Следователно белият фосфор се съхранява под вода, с която не реагира. Белият фосфор е много токсичен. При дългосрочно съхранение, както и при нагряване, се превръща в бял фосфор в червена модификация(за първи път е получен едва през 1847 г.). Името червен фосфор се отнася до няколко модификации, които се различават по плътност и цвят: варира от оранжево до тъмночервено и дори лилаво. Всички разновидности на червения фосфор са неразтворими в органични разтворители и в сравнение с белия фосфор те са по-малко реактивни и имат полимерна структура: това са P4 тетраедри, свързани помежду си в безкрайни вериги (фиг. 2).
При дългосрочно съхранение, както и при нагряване, се превръща в бял фосфор в червена модификация(за първи път е получен едва през 1847 г.). Името червен фосфор се отнася до няколко модификации, които се различават по плътност и цвят: варира от оранжево до тъмночервено и дори лилаво. Всички разновидности на червения фосфор са неразтворими в органични разтворители и в сравнение с белия фосфор те са по-малко реактивни и имат полимерна структура: това са P4 тетраедри, свързани помежду си в безкрайни вериги (фиг. 2). Най-стабилната модификация на фосфора е черен фосфор. Получава се чрез алотропна трансформация на бял фосфор при t=220 0 C и повишено налягане. На външен вид прилича на графит. Кристалната структура на черния фосфор е слоеста, състояща се от гофрирани слоеве (фиг. 3). Черният фосфор е най-малко активната модификация на фосфора. При нагряване без достъп на въздух той, подобно на червеното, се превръща в пара, от която кондензира в бял фосфор.
Най-стабилната модификация на фосфора е черен фосфор. Получава се чрез алотропна трансформация на бял фосфор при t=220 0 C и повишено налягане. На външен вид прилича на графит. Кристалната структура на черния фосфор е слоеста, състояща се от гофрирани слоеве (фиг. 3). Черният фосфор е най-малко активната модификация на фосфора. При нагряване без достъп на въздух той, подобно на червеното, се превръща в пара, от която кондензира в бял фосфор. фосфорна киселина.
Известни са няколко киселини, съдържащи фосфор. Най-важната от тях е ортофосфорната киселина H 3 PO 4 (фиг. 5).
фосфорна киселина.
Известни са няколко киселини, съдържащи фосфор. Най-важната от тях е ортофосфорната киселина H 3 PO 4 (фиг. 5).