फास्फोरस प्रकृति में कहाँ पाया जाता है? फॉस्फोरस और उसके यौगिक - नॉलेज हाइपरमार्केट
>>रसायन विज्ञान: फास्फोरस और उसके यौगिक
परमाणुओं की संरचना और गुण . आवर्त सारणी के समूह V के मुख्य उपसमूह के नाइट्रोजन के बाद अगला प्रतिनिधि गैर-धातु तत्व फॉस्फोरस आर है। नाइट्रोजन परमाणुओं की तुलना में परमाणुओं में एक बड़ा त्रिज्या, कम इलेक्ट्रोनगेटिविटी मूल्य होता है, और इसलिए अधिक स्पष्ट कम करने वाले गुण होते हैं। फॉस्फोरस परमाणु के -3 ऑक्सीकरण अवस्था वाले यौगिक नाइट्रोजन की तुलना में कम आम हैं (केवल फॉस्फाइड में - धातुओं के साथ फॉस्फोरस के यौगिक, उदाहरण के लिए Ca3P2, Na3P)। अधिकतर, फॉस्फोरस यौगिकों में +5 की ऑक्सीकरण अवस्था प्रदर्शित करता है। लेकिन हाइड्रोजन के साथ इसका यौगिक - फॉस्फीन PH3 - एक दुर्लभ मामला है जब विभिन्न तत्वों के परमाणुओं के बीच सहसंयोजक बंधन इस तथ्य के कारण गैर-ध्रुवीय होता है कि फॉस्फोरस और हाइड्रोजन की इलेक्ट्रोनगेटिविटी का मान लगभग समान होता है।
फॉस्फोरस एक साधारण पदार्थ है. रासायनिक तत्व फॉस्फोरस कई एलोट्रोपिक संशोधन बनाता है। इनमें से, आप पहले से ही दो सरल पदार्थों को जानते हैं: सफेद फास्फोरस और लाल फास्फोरस।
सफेद फास्फोरस में एक आणविक क्रिस्टल जाली होती है जिसमें P4 अणु होते हैं। पानी में अघुलनशील, कार्बन डाइसल्फ़ाइड में घुलनशील। यह हवा में आसानी से ऑक्सीकृत हो जाता है और पाउडर के रूप में भी प्रज्वलित हो जाता है।
सफेद फास्फोरस बहुत जहरीला होता है। इसका विशेष गुण इसके ऑक्सीकरण के कारण अंधेरे में चमकने की क्षमता है। इसे पानी के अंदर संग्रहित किया जाता है.
लाल फास्फोरस एक गहरे लाल रंग का पाउडर है। यह पानी या कार्बन डाइसल्फ़ाइड में नहीं घुलता है। हवा में यह धीरे-धीरे ऑक्सीकरण करता है और स्वचालित रूप से प्रज्वलित नहीं होता है। गैर विषैला और अंधेरे में चमकता नहीं है।
जब लाल फास्फोरस को रुई के फाहे से बंद टेस्ट ट्यूब में गर्म किया जाता है, तो यह सफेद फास्फोरस (केंद्रित वाष्प) में बदल जाता है, और यदि स्वाब को बाहर निकाला जाता है, तो सफेद फास्फोरस हवा में चमकने लगेगा (चित्र 35)। यह प्रयोग सफेद फास्फोरस की ज्वलनशीलता को दर्शाता है।
लाल और सफेद फास्फोरस के रासायनिक गुण समान हैं, लेकिन सफेद फास्फोरस रासायनिक रूप से अधिक सक्रिय है। तो, ये दोनों, गैर-धातुओं के अनुरूप, धातुओं के साथ परस्पर क्रिया करते हैं, जिससे फॉस्फाइड बनते हैं:
सफेद फास्फोरस हवा में स्वतः ही प्रज्वलित हो जाता है, जबकि लाल फास्फोरस प्रज्वलित होने पर जल जाता है। दोनों ही मामलों में, फॉस्फोरस ऑक्साइड बनता है, जो गाढ़े सफेद धुएं के रूप में निकलता है:
4पी + 502 = 2पी205

चावल। 35. लाल फास्फोरस के सफेद में संक्रमण को दर्शाने वाला एक प्रयोग
फॉस्फोरस सीधे हाइड्रोजन के साथ प्रतिक्रिया नहीं करता है; फॉस्फीन PH3 अप्रत्यक्ष रूप से प्राप्त किया जा सकता है, उदाहरण के लिए फॉस्फाइड से:
Ca3P2 + 6HCl = 3CaCl2 + 2PH3
फॉस्फीन- एक अप्रिय गंध वाली बहुत जहरीली गैस। हवा में आसानी से ज्वलनशील. फॉस्फीन का यह गुण दलदल विल-ओ-द-विस्प्स की उपस्थिति की व्याख्या करता है।
फास्फोरस यौगिक
. जब फॉस्फीन या फॉस्फोरस जलता है, जैसा कि आप पहले से ही जानते हैं, फॉस्फोरस ऑक्साइड P205 बनता है - एक सफेद हीड्रोस्कोपिक पाउडर। यह एक विशिष्ट अम्लीय ऑक्साइड है, जिसमें अम्लीय ऑक्साइड के सभी गुण मौजूद हैं।
फॉस्फोरस ऑक्साइड फॉस्फोरिक एसिड H3P04 से मेल खाता है। यह एक ठोस पारदर्शी क्रिस्टलीय पदार्थ है, जो किसी भी अनुपात में पानी में अत्यधिक घुलनशील होता है। ट्राइबेसिक एसिड के रूप में, H3P04 लवणों की तीन श्रृंखलाएँ बनाता है:
मध्यम लवण या फॉस्फेट, उदाहरण के लिए Ca3(PO4)2, जो क्षार धातु फॉस्फेट को छोड़कर, पानी में अघुलनशील होते हैं;
अम्ल लवण - डाइहाइड्रोजन फॉस्फेट, उदाहरण के लिए Ca(H2P04)2, जिनमें से अधिकांश पानी में अत्यधिक घुलनशील होते हैं;
एसिड लवण - हाइड्रोफॉस्फेट, उदाहरण के लिए CaHPO4, जो पानी में थोड़ा घुलनशील होते हैं (सोडियम, पोटेशियम और अमोनियम फॉस्फेट को छोड़कर), यानी, वे घुलनशीलता में फॉस्फेट और हाइड्रोफॉस्फेट के बीच एक मध्यवर्ती स्थिति पर कब्जा कर लेते हैं।
प्रकृति में, फास्फोरस मुक्त रूप में नहीं होता है - केवल यौगिकों के रूप में। सबसे महत्वपूर्ण प्राकृतिक फॉस्फोरस यौगिक खनिज फॉस्फोराइट्स और एपेटाइट हैं। इनका थोक कैल्शियम फॉस्फेट Ca3(P04)2 है, जिससे फास्फोरस औद्योगिक रूप से प्राप्त किया जाता है।
फास्फोरस का जैविक महत्व. फास्फोरस मानव, पशु और पौधों के जीवों के ऊतकों का एक स्थायी घटक है। मानव शरीर में अधिकांश फास्फोरस कैल्शियम से बंधा होता है। एक बच्चे को कंकाल बनाने के लिए कैल्शियम जितनी ही फास्फोरस की आवश्यकता होती है। हड्डियों के अलावा, फास्फोरस तंत्रिका और मस्तिष्क के ऊतकों, रक्त और दूध में पाया जाता है। पौधों में, जानवरों की तरह, फास्फोरस प्रोटीन का हिस्सा है।
फास्फोरस से जो भोजन, मुख्य रूप से अंडे, मांस, दूध और ब्रेड के साथ मानव शरीर में प्रवेश करता है, एटीपी का निर्माण होता है - एडेनोसिन ट्राइफॉस्फोरिक एसिड, जो ऊर्जा के संग्राहक और वाहक के रूप में कार्य करता है, साथ ही न्यूक्लिक एसिड - डीएनए और आरएनए, जो संचारित करते हैं। शरीर के वंशानुगत गुण. एटीपी का सेवन शरीर के सक्रिय रूप से काम करने वाले अंगों में सबसे अधिक तीव्रता से किया जाता है: यकृत, मांसपेशियां, मस्तिष्क। यह कोई आश्चर्य की बात नहीं है कि प्रसिद्ध खनिजविज्ञानी, भू-रसायन विज्ञान के संस्थापकों में से एक, शिक्षाविद ए.ई. फर्समैन ने फॉस्फोरस को "जीवन और विचार का तत्व" कहा।
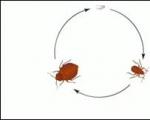
जैसा कि कहा गया है, फॉस्फोरस प्रकृति में मिट्टी में पाए जाने वाले (या प्राकृतिक जल में घुले हुए) यौगिकों के रूप में मौजूद है। फास्फोरस पौधों द्वारा मिट्टी से निकाला जाता है, और जानवर पौधों के खाद्य पदार्थों से फास्फोरस प्राप्त करते हैं। पौधों और जानवरों के जीवों की मृत्यु के बाद, फास्फोरस मिट्टी में वापस आ जाता है। प्रकृति में फॉस्फोरस चक्र इस प्रकार होता है (चित्र 36)।
फास्फोरस और उसके यौगिकों का अनुप्रयोग
. लाल फॉस्फोरस का उपयोग माचिस और फॉस्फोरिक एसिड का उत्पादन करने के लिए किया जाता है, जो बदले में, फॉस्फेट उर्वरकों और पशुओं के लिए चारा योजक का उत्पादन करने के लिए उपयोग किया जाता है। इसके अलावा, फॉस्फोरस का उपयोग कीटनाशकों के उत्पादन के लिए किया जाता है (डाइक्लोरवोस, क्लोरोफोस, आदि के डिब्बे याद रखें)। 
फॉस्फोरस की खोज
. फॉस्फोरस की खोज 1669 में जर्मन कीमियागर जी. ब्रांड ने की थी और इसे इसका नाम अंधेरे में चमकने की क्षमता (ग्रीक फॉस्फोरस - चमकदार) के कारण मिला।
1. फास्फोरस की अपररूपता: सफेद फास्फोरस, लाल फास्फोरस।
2. फॉस्फोरस के गुण: फॉस्फाइड, फॉस्फीन, फॉस्फोरस ऑक्साइड (V) का निर्माण।
3. फॉस्फोरिक एसिड और इसके लवणों की तीन श्रृंखलाएँ: फॉस्फेट, हाइड्रोजन फॉस्फेट और डाइहाइड्रोजन फॉस्फेट।
4. फॉस्फोरस (कैल्शियम फॉस्फेट, एटीपी, डीएनए और आरएनए) का जैविक महत्व।
5. फास्फोरस और उसके यौगिकों का अनुप्रयोग।
तीन प्रकार के सोडियम तथा फॉस्फोरिक अम्ल लवणों के सूत्र लिखिए, उनके नाम लिखिए तथा उनके पृथक्करण के समीकरण लिखिए।
उन प्रतिक्रिया समीकरणों को लिखें जिनका उपयोग निम्नलिखित परिवर्तनों को पूरा करने के लिए किया जा सकता है:
P -> Mg3P2 -> PH3 -> P205 -> H3P04 -> Ca3(P04)2
पाठ सामग्री पाठ नोट्सफ़्रेम पाठ प्रस्तुति त्वरण विधियों इंटरैक्टिव तकनीकों का समर्थन करना अभ्यास कार्य और अभ्यास स्व-परीक्षण कार्यशालाएँ, प्रशिक्षण, मामले, प्रश्न, होमवर्क चर्चा प्रश्न, छात्रों से अलंकारिक प्रश्न रेखांकन ऑडियो, वीडियो क्लिप और मल्टीमीडियातस्वीरें, चित्र, ग्राफिक्स, टेबल, आरेख, हास्य, उपाख्यान, चुटकुले, कॉमिक्स, दृष्टान्त, कहावतें, वर्ग पहेली, उद्धरण ऐड-ऑन एब्सट्रैक्टजिज्ञासु क्रिब्स पाठ्यपुस्तकों के लिए आलेख ट्रिक्स, अन्य शब्दों का बुनियादी और अतिरिक्त शब्दकोश पाठ्यपुस्तकों और पाठों में सुधार करनापाठ्यपुस्तक में त्रुटियों को सुधारनापाठ्यपुस्तक में एक अंश को अद्यतन करना, पाठ में नवाचार के तत्व, पुराने ज्ञान को नए से बदलना केवल शिक्षकों के लिए उत्तम पाठवर्ष के लिए कैलेंडर योजना; पद्धति संबंधी सिफारिशें; चर्चा कार्यक्रम एकीकृत पाठफास्फोरस और उसके यौगिक
परिचय
अध्याय I. फास्फोरस एक तत्व के रूप में और एक साधारण पदार्थ के रूप में
1.1. प्रकृति में फास्फोरस
1.2. भौतिक गुण
1.3. रासायनिक गुण
1.4. रसीद
1.5. आवेदन
दूसरा अध्याय। फास्फोरस यौगिक
2.1. आक्साइड
2.2. अम्ल और उनके लवण
2.3. फॉस्फीन
अध्याय III. फास्फोरस उर्वरक
निष्कर्ष
ग्रन्थसूची
परिचय
फॉस्फोरस (अव्य. फॉस्फोरस) पी मेंडेलीव की आवधिक प्रणाली के समूह V का एक रासायनिक तत्व है, परमाणु क्रमांक 15, परमाणु द्रव्यमान 30.973762(4)। आइए फॉस्फोरस परमाणु की संरचना पर विचार करें। फॉस्फोरस परमाणु के बाहरी ऊर्जा स्तर में पाँच इलेक्ट्रॉन होते हैं। ग्राफ़िक रूप से यह इस तरह दिखता है:1एस 2 2एस 2 2पी 6 3एस 2 3पी 3 3डी 0

1699 में, हैम्बर्ग के रसायनशास्त्री एच. ब्रांड ने एक "दार्शनिक पत्थर" की खोज में, जो कथित तौर पर आधार धातुओं को सोने में बदलने में सक्षम था, कोयले और रेत के साथ मूत्र को वाष्पित करके, एक सफेद मोम जैसा पदार्थ निकाला जो चमक सकता था।
"फॉस्फोरस" नाम ग्रीक से आया है। "फॉस" - प्रकाश और "फोरोस" - वाहक। रूस में, "फॉस्फोरस" शब्द 1746 में एम.वी. द्वारा पेश किया गया था। लोमोनोसोव।
मुख्य फॉस्फोरस यौगिकों में ऑक्साइड, एसिड और उनके लवण (फॉस्फेट, डाइहाइड्रोजन फॉस्फेट, हाइड्रोजन फॉस्फेट, फॉस्फाइड, फॉस्फाइट्स) शामिल हैं।
उर्वरकों में फास्फोरस युक्त पदार्थ काफी मात्रा में पाये जाते हैं। ऐसे उर्वरकों को फास्फोरस उर्वरक कहा जाता है।
अध्याय मैं फास्फोरस एक तत्व के रूप में और एक साधारण पदार्थ के रूप में
1.1 प्रकृति में फास्फोरस
फॉस्फोरस सामान्य तत्वों में से एक है। पृथ्वी की पपड़ी में कुल सामग्री लगभग 0.08% है। आसानी से ऑक्सीकरण होने के कारण फॉस्फोरस प्रकृति में केवल यौगिकों के रूप में ही पाया जाता है। मुख्य फॉस्फोरस खनिज फॉस्फोराइट्स और एपेटाइट हैं, बाद वाले में सबसे आम फ्लोरापैटाइट 3Ca 3 (PO 4) 2 CaF 2 है। फॉस्फोराइट यूराल, वोल्गा क्षेत्र, साइबेरिया, कजाकिस्तान, एस्टोनिया और बेलारूस में व्यापक हैं। एपेटाइट का सबसे बड़ा भंडार कोला प्रायद्वीप पर स्थित है।
फास्फोरस जीवित जीवों के लिए एक आवश्यक तत्व है। यह हड्डियों, मांसपेशियों, मस्तिष्क के ऊतकों और तंत्रिकाओं में मौजूद होता है। एटीपी अणु फॉस्फोरस - एडेनोसिन ट्राइफॉस्फोरिक एसिड (एटीपी एक संग्राहक और ऊर्जा का वाहक है) से निर्मित होते हैं। वयस्क मानव शरीर में औसतन लगभग 4.5 किलोग्राम फॉस्फोरस होता है, मुख्यतः कैल्शियम के साथ।
फास्फोरस पौधों में भी पाया जाता है।
प्राकृतिक फॉस्फोरस में केवल एक स्थिर आइसोटोप 31 R होता है। आज, फॉस्फोरस के छह रेडियोधर्मी आइसोटोप ज्ञात हैं।
1.2 भौतिक गुण
फास्फोरस में कई एलोट्रोपिक संशोधन हैं - सफेद, लाल, काला, भूरा, बैंगनी फास्फोरस, आदि। इनमें से पहले तीन का सबसे अधिक अध्ययन किया गया है।
सफेद फास्फोरस- एक रंगहीन, पीले रंग का क्रिस्टलीय पदार्थ जो अंधेरे में चमकता है। इसका घनत्व 1.83 ग्राम/सेमी3 है। पानी में अघुलनशील, कार्बन डाइसल्फ़ाइड में घुलनशील। इसमें लहसुन की विशिष्ट गंध होती है। गलनांक 44°C, ऑटो-इग्निशन तापमान 40°C। सफेद फास्फोरस को ऑक्सीकरण से बचाने के लिए इसे पानी के नीचे अंधेरे में संग्रहित किया जाता है (प्रकाश में यह लाल फास्फोरस में बदल जाता है)। ठंड में, सफेद फास्फोरस नाजुक होता है; 15 डिग्री सेल्सियस से ऊपर के तापमान पर यह नरम हो जाता है और चाकू से काटा जा सकता है।
सफेद फास्फोरस के अणुओं में एक क्रिस्टल जाली होती है, जिसके नोड्स पर पी 4 अणु होते हैं, जो टेट्राहेड्रोन के आकार के होते हैं।
प्रत्येक फॉस्फोरस परमाणु तीन σ बंधों द्वारा अन्य तीन परमाणुओं से जुड़ा होता है।
सफेद फास्फोरस जहरीला होता है और जलने का कारण बनता है जिसे ठीक करना मुश्किल होता है।
लाल फास्फोरस- गहरे लाल रंग का एक पाउडर जैसा पदार्थ, गंधहीन, पानी और कार्बन डाइसल्फ़ाइड में नहीं घुलता और चमकता नहीं है। ज्वलन तापमान 260°C, घनत्व 2.3 ग्राम/सेमी 3। लाल फास्फोरस कई एलोट्रोपिक संशोधनों का मिश्रण है जो रंग में भिन्न होता है (स्कार्लेट से बैंगनी तक)। लाल फास्फोरस के गुण इसके उत्पादन की स्थितियों पर निर्भर करते हैं। जहरीला नहीं.
काला फास्फोरसयह ग्रेफाइट जैसा दिखता है, छूने पर चिकना लगता है और इसमें अर्धचालक गुण होते हैं। घनत्व 2.7 ग्राम/सेमी3।
लाल और काले फास्फोरस में एक परमाणु क्रिस्टल जाली होती है।
1.3 रासायनिक गुण
फॉस्फोरस एक अधातु है। यौगिकों में, यह आमतौर पर +5 की ऑक्सीकरण अवस्था प्रदर्शित करता है, कम अक्सर - +3 और -3 (केवल फॉस्फाइड में)।
लाल फास्फोरस की तुलना में सफेद फास्फोरस के साथ प्रतिक्रिया आसान होती है।
I. सरल पदार्थों के साथ परस्पर क्रिया।
1. हैलोजन के साथ परस्पर क्रिया:
2P + 3Cl 2 = 2PCl 3 (फॉस्फोरस (III) क्लोराइड),
पीसीएल 3 + सीएल 2 = पीसीएल 5 (फॉस्फोरस (वी) क्लोराइड)।
2. अधातुओं के साथ अन्योन्यक्रिया:
2पी + 3एस = पी 2 एस 3 (फॉस्फोरस (III) सल्फाइड।
3. धातुओं के साथ अन्योन्यक्रिया:
2पी + 3सीए = सीए 3 पी 2 (कैल्शियम फॉस्फाइड)।
4. ऑक्सीजन के साथ परस्पर क्रिया:
4पी + 5ओ 2 = 2पी 2 ओ 5 (फॉस्फोरस (वी) ऑक्साइड, फॉस्फोरिक एनहाइड्राइड)।
द्वितीय. जटिल पदार्थों के साथ अंतःक्रिया.
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO.
1.4 रसीद
फॉस्फोरस को कुचले हुए फॉस्फोराइट्स और एपेटाइट्स से प्राप्त किया जाता है, बाद वाले को कोयले और रेत के साथ मिलाया जाता है और 1500 डिग्री सेल्सियस पर भट्टियों में कैलक्लाइंड किया जाता है:
2Ca 3 (PO 4) 2 + 10C + 6SiO 2
6CaSiO3 + P4 + 10CO।फॉस्फोरस को वाष्प के रूप में छोड़ा जाता है, जो पानी के नीचे रिसीवर में संघनित होकर सफेद फॉस्फोरस बनाता है।
जब हवा की पहुंच के बिना 250-300°C तक गर्म किया जाता है, तो सफेद फास्फोरस लाल रंग में बदल जाता है।
काला फास्फोरस सफेद फास्फोरस को बहुत उच्च दबाव (200 डिग्री सेल्सियस और 1200 एमपीए) पर लंबे समय तक गर्म करने से प्राप्त होता है।
1.5 आवेदन
लाल फास्फोरस का उपयोग माचिस के निर्माण में किया जाता है (चित्र देखें)। यह माचिस की डिब्बी की पार्श्व सतह पर लगाए गए मिश्रण का हिस्सा है। माचिस की तीली का मुख्य घटक बर्थोलेट नमक KClO 3 है। माचिस की तीली के स्नेहक पदार्थ के विरुद्ध घर्षण के कारण हवा में मौजूद फॉस्फोरस के कण प्रज्वलित हो जाते हैं। फॉस्फोरस की ऑक्सीकरण प्रतिक्रिया के परिणामस्वरूप, गर्मी निकलती है, जिससे बर्थोलेट नमक का अपघटन होता है।
केसीएल+.
परिणामी ऑक्सीजन माचिस की तीली को प्रज्वलित करने में मदद करती है।
फॉस्फोरस का उपयोग धातुकर्म में किया जाता है। इसका उपयोग कंडक्टर बनाने के लिए किया जाता है और यह कुछ धातु सामग्री, जैसे टिन कांस्य, का एक घटक है।
फॉस्फोरस का उपयोग फॉस्फोरिक एसिड और कीटनाशकों (डाइक्लोरवोस, क्लोरोफोस, आदि) के उत्पादन में भी किया जाता है।
सफेद फास्फोरस का उपयोग धुआं स्क्रीन बनाने के लिए किया जाता है, क्योंकि इसके दहन से सफेद धुआं पैदा होता है।
अध्याय द्वितीय . फास्फोरस यौगिक
2.1 ऑक्साइड
फॉस्फोरस कई ऑक्साइड बनाता है। उनमें से सबसे महत्वपूर्ण फॉस्फोरस ऑक्साइड (वी) पी 4 ओ 10 और फॉस्फोरस ऑक्साइड (III) पी 4 ओ 6 हैं। अक्सर उनके सूत्र सरलीकृत रूप में लिखे जाते हैं - पी 2 ओ 5 और पी 2 ओ 3। इन ऑक्साइडों की संरचना फॉस्फोरस परमाणुओं की चतुष्फलकीय व्यवस्था को बरकरार रखती है।
फॉस्फोरस ऑक्साइड(III) पी 4 ओ 6 एक मोमी क्रिस्टलीय द्रव्यमान है जो 22.5 डिग्री सेल्सियस पर पिघल जाता है और रंगहीन तरल में बदल जाता है। ज़हरीला.
ठंडे पानी में घुलने पर यह फॉस्फोरस एसिड बनाता है:
पी 4 ओ 6 + 6एच 2 ओ = 4एच 3 पीओ 3,
और क्षार के साथ प्रतिक्रिया करते समय - संबंधित लवण (फॉस्फाइट्स)।
मजबूत कम करने वाला एजेंट। ऑक्सीजन के साथ बातचीत करते समय, यह पी 4 ओ 10 में ऑक्सीकृत हो जाता है।
फास्फोरस (III) ऑक्साइड ऑक्सीजन की अनुपस्थिति में सफेद फास्फोरस के ऑक्सीकरण द्वारा प्राप्त किया जाता है।
फॉस्फोरस ऑक्साइड(वी) पी 4 ओ 10 - सफेद क्रिस्टलीय पाउडर। ऊर्ध्वपातन तापमान 36°C. इसमें कई संशोधन हैं, जिनमें से एक (तथाकथित अस्थिर) की संरचना पी 4 ओ 10 है। इस संशोधन का क्रिस्टल जाली कमजोर अंतर-आण्विक बलों द्वारा एक दूसरे से जुड़े पी 4 ओ 10 अणुओं से बना है, जो गर्म होने पर आसानी से टूट जाते हैं। इसलिए इस किस्म की अस्थिरता. अन्य संशोधन बहुलक हैं। इनका निर्माण PO 4 टेट्राहेड्रा की अंतहीन परतों से होता है।
जब P 4 O 10 पानी के साथ परस्पर क्रिया करता है, तो फॉस्फोरिक एसिड बनता है:
पी 4 ओ 10 + 6एच 2 ओ = 4एच 3 पीओ 4।
एक अम्लीय ऑक्साइड होने के कारण, P 4 O 10 क्षारीय ऑक्साइड और हाइड्रॉक्साइड के साथ प्रतिक्रिया करता है।
यह अतिरिक्त ऑक्सीजन (शुष्क हवा) में फॉस्फोरस के उच्च तापमान ऑक्सीकरण के दौरान बनता है।
अपनी असाधारण हीड्रोस्कोपिसिटी के कारण, फॉस्फोरस (वी) ऑक्साइड का उपयोग प्रयोगशाला और औद्योगिक प्रौद्योगिकी में सुखाने और निर्जलीकरण एजेंट के रूप में किया जाता है। अपने सुखाने के प्रभाव में यह अन्य सभी पदार्थों से आगे निकल जाता है। एनहाइड्राइड बनाने के लिए निर्जल पर्क्लोरिक एसिड से रासायनिक रूप से बंधे पानी को हटा दिया जाता है:
4HClO4 + P4O10 = (HPO3)4 + 2Cl2O7.
2.2 अम्ल और उनके लवण
ए) फॉस्फोरस अम्ल H3PO3. निर्जल फॉस्फोरस एसिड एच 3 पीओ 3 1.65 ग्राम/सेमी 3 के घनत्व के साथ क्रिस्टल बनाता है, जो 74 डिग्री सेल्सियस पर पिघलता है।
संरचनात्मक सूत्र:
.जब निर्जल H 3 PO 3 को गर्म किया जाता है, तो एक अनुपातहीन प्रतिक्रिया (ऑटो-ऑक्सीकरण-स्व-उपचार) होती है:
4एच 3 पीओ 3 = पीएच 3 + 3एच 3 पीओ 4.
फॉस्फोरस अम्ल लवण - फॉस्फेट. उदाहरण के लिए, K 3 PO 3 (पोटेशियम फ़ॉस्फाइट) या Mg 3 (PO 3) 2 (मैग्नीशियम फ़ॉस्फाइट)।
फॉस्फोरस एसिड H 3 PO 3 फॉस्फोरस (III) ऑक्साइड को पानी में घोलकर या फॉस्फोरस (III) क्लोराइड PCl 3 के हाइड्रोलिसिस द्वारा प्राप्त किया जाता है:
РCl 3 + 3H 2 O = H 3 PO 3 + 3HCl।
बी) फॉस्फोरिक एसिड (ऑर्थोफोस्फोरिक एसिड) एच 3 पीओ 4 .
निर्जल फॉस्फोरिक एसिड हल्के पारदर्शी क्रिस्टल के रूप में प्रकट होता है जो कमरे के तापमान पर हवा में फैलता है। गलनांक 42.35°C. फॉस्फोरिक एसिड पानी के साथ किसी भी सांद्रता का घोल बनाता है।
परिचय
अध्याय I. फास्फोरस एक तत्व के रूप में और एक साधारण पदार्थ के रूप में
1.1. प्रकृति में फास्फोरस
1.2. भौतिक गुण
1.3. रासायनिक गुण
1.4. रसीद
1.5. आवेदन
दूसरा अध्याय। फास्फोरस यौगिक
2.1. आक्साइड
2.2. अम्ल और उनके लवण
2.3. फॉस्फीन
अध्याय III. फास्फोरस उर्वरक
निष्कर्ष
ग्रन्थसूची
परिचय
फॉस्फोरस (अव्य. फॉस्फोरस) पी मेंडेलीव की आवधिक प्रणाली के समूह V का एक रासायनिक तत्व है, परमाणु क्रमांक 15, परमाणु द्रव्यमान 30.973762(4)। आइए फॉस्फोरस परमाणु की संरचना पर विचार करें। फॉस्फोरस परमाणु के बाहरी ऊर्जा स्तर में पाँच इलेक्ट्रॉन होते हैं। ग्राफ़िक रूप से यह इस तरह दिखता है:
1s22s22p63s23p33d0

1699 में, हैम्बर्ग के रसायनशास्त्री एच. ब्रांड ने एक "दार्शनिक पत्थर" की खोज में, जो कथित तौर पर आधार धातुओं को सोने में बदलने में सक्षम था, कोयले और रेत के साथ मूत्र को वाष्पित करके, एक सफेद मोम जैसा पदार्थ निकाला जो चमक सकता था।
"फॉस्फोरस" नाम ग्रीक से आया है। "फॉस" - प्रकाश और "फोरोस" - वाहक। रूस में, "फॉस्फोरस" शब्द 1746 में एम.वी. द्वारा पेश किया गया था। लोमोनोसोव।
मुख्य फॉस्फोरस यौगिकों में ऑक्साइड, एसिड और उनके लवण (फॉस्फेट, डाइहाइड्रोजन फॉस्फेट, हाइड्रोजन फॉस्फेट, फॉस्फाइड, फॉस्फाइट्स) शामिल हैं।
उर्वरकों में फास्फोरस युक्त पदार्थ काफी मात्रा में पाये जाते हैं। ऐसे उर्वरकों को फास्फोरस उर्वरक कहा जाता है।
अध्यायमैंफास्फोरस एक तत्व के रूप में और एक साधारण पदार्थ के रूप में
प्रकृति में फास्फोरस
फॉस्फोरस सामान्य तत्वों में से एक है। पृथ्वी की पपड़ी में कुल सामग्री लगभग 0.08% है। आसानी से ऑक्सीकरण होने के कारण फॉस्फोरस प्रकृति में केवल यौगिकों के रूप में ही पाया जाता है। मुख्य फॉस्फोरस खनिज फॉस्फोराइट्स और एपेटाइट हैं, बाद वाले में सबसे आम फ्लोरापैटाइट 3Ca3(PO4)2 CaF2 है। फॉस्फोराइट यूराल, वोल्गा क्षेत्र, साइबेरिया, कजाकिस्तान, एस्टोनिया और बेलारूस में व्यापक हैं। एपेटाइट का सबसे बड़ा भंडार कोला प्रायद्वीप पर स्थित है।
फास्फोरस जीवित जीवों के लिए एक आवश्यक तत्व है। यह हड्डियों, मांसपेशियों, मस्तिष्क के ऊतकों और तंत्रिकाओं में मौजूद होता है। एटीपी अणु फॉस्फोरस - एडेनोसिन ट्राइफॉस्फोरिक एसिड (एटीपी एक संग्राहक और ऊर्जा का वाहक है) से निर्मित होते हैं। वयस्क मानव शरीर में औसतन लगभग 4.5 किलोग्राम फॉस्फोरस होता है, मुख्यतः कैल्शियम के साथ।
फास्फोरस पौधों में भी पाया जाता है।
प्राकृतिक फास्फोरस में केवल एक स्थिर आइसोटोप, 31P होता है। आज, फॉस्फोरस के छह रेडियोधर्मी समस्थानिक ज्ञात हैं।
भौतिक गुण
फास्फोरस में कई एलोट्रोपिक संशोधन हैं - सफेद, लाल, काला, भूरा, बैंगनी फास्फोरस, आदि। इनमें से पहले तीन का सबसे अधिक अध्ययन किया गया है।
सफेद फास्फोरस एक रंगहीन, पीले रंग का क्रिस्टलीय पदार्थ है जो अंधेरे में चमकता है। इसका घनत्व 1.83 ग्राम/सेमी3 है। पानी में अघुलनशील, कार्बन डाइसल्फ़ाइड में घुलनशील। इसमें लहसुन की विशिष्ट गंध होती है। गलनांक 44°C, ऑटो-इग्निशन तापमान 40°C। सफेद फास्फोरस को ऑक्सीकरण से बचाने के लिए इसे पानी के नीचे अंधेरे में संग्रहित किया जाता है (प्रकाश में यह लाल फास्फोरस में बदल जाता है)। ठंड में, सफेद फास्फोरस नाजुक होता है; 15 डिग्री सेल्सियस से ऊपर के तापमान पर यह नरम हो जाता है और चाकू से काटा जा सकता है।
सफेद फॉस्फोरस अणुओं में एक क्रिस्टल जाली होती है, जिसके नोड्स पर टेट्राहेड्रोन के आकार के P4 अणु होते हैं।
प्रत्येक फॉस्फोरस परमाणु तीन σ बंधों द्वारा अन्य तीन परमाणुओं से जुड़ा होता है।
सफेद फास्फोरस जहरीला होता है और जलने का कारण बनता है जिसे ठीक करना मुश्किल होता है।
लाल फास्फोरस एक गहरा लाल, गंधहीन, पाउडरयुक्त पदार्थ है जो पानी या कार्बन डाइसल्फ़ाइड में नहीं घुलता और चमकता नहीं है। इग्निशन तापमान 260°C, घनत्व 2.3 ग्राम/सेमी3। लाल फास्फोरस कई एलोट्रोपिक संशोधनों का मिश्रण है जो रंग में भिन्न होता है (स्कार्लेट से बैंगनी तक)। लाल फास्फोरस के गुण इसके उत्पादन की स्थितियों पर निर्भर करते हैं। जहरीला नहीं.
काला फॉस्फोरस दिखने में ग्रेफाइट के समान होता है, छूने पर चिकना होता है और इसमें अर्धचालक गुण होते हैं। घनत्व 2.7 ग्राम/सेमी3।
लाल और काले फास्फोरस में एक परमाणु क्रिस्टल जाली होती है।
रासायनिक गुण
फॉस्फोरस एक अधातु है। यौगिकों में, यह आमतौर पर +5 की ऑक्सीकरण अवस्था प्रदर्शित करता है, कम अक्सर - +3 और -3 (केवल फॉस्फाइड में)।
लाल फास्फोरस की तुलना में सफेद फास्फोरस के साथ प्रतिक्रिया आसान होती है।
I. सरल पदार्थों के साथ परस्पर क्रिया।
हैलोजन के साथ परस्पर क्रिया:
2P + 3Cl2 = 2PCl3 (फॉस्फोरस (III) क्लोराइड),
पीसीएल3 + सीएल2 = पीसीएल5 (फॉस्फोरस (वी) क्लोराइड)।
गैर-धातुओं के साथ परस्पर क्रिया:
2P + 3S = P2S3 (फॉस्फोरस (III) सल्फाइड।
धातुओं के साथ परस्पर क्रिया:
2P + 3Ca = Ca3P2 (कैल्शियम फॉस्फाइड)।
ऑक्सीजन के साथ परस्पर क्रिया:
4P + 5O2 = 2P2O5 (फॉस्फोरस (V) ऑक्साइड, फॉस्फोरस एनहाइड्राइड)।
द्वितीय. जटिल पदार्थों के साथ अंतःक्रिया.
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO.
रसीद
फॉस्फोरस को कुचले हुए फॉस्फोराइट्स और एपेटाइट्स से प्राप्त किया जाता है, बाद वाले को कोयले और रेत के साथ मिलाया जाता है और 1500 डिग्री सेल्सियस पर भट्टियों में कैलक्लाइंड किया जाता है:
2Ca3(PO4)2 + 10C + 6SiO2  6CaSiO3 + P4 + 10CO।
6CaSiO3 + P4 + 10CO।
फॉस्फोरस को वाष्प के रूप में छोड़ा जाता है, जो पानी के नीचे रिसीवर में संघनित होकर सफेद फॉस्फोरस बनाता है।
जब हवा की पहुंच के बिना 250-300°C तक गर्म किया जाता है, तो सफेद फास्फोरस लाल रंग में बदल जाता है।
काला फास्फोरस सफेद फास्फोरस को बहुत उच्च दबाव (200 डिग्री सेल्सियस और 1200 एमपीए) पर लंबे समय तक गर्म करने से प्राप्त होता है।
आवेदन
लाल फास्फोरस का उपयोग माचिस के निर्माण में किया जाता है (चित्र देखें)। यह माचिस की डिब्बी की पार्श्व सतह पर लगाए गए मिश्रण का हिस्सा है। माचिस की तीली का मुख्य घटक बर्थोलेट नमक KClO3 है। माचिस की तीली के स्नेहक पदार्थ के विरुद्ध घर्षण के कारण हवा में मौजूद फॉस्फोरस के कण प्रज्वलित हो जाते हैं। फॉस्फोरस की ऑक्सीकरण प्रतिक्रिया के परिणामस्वरूप, गर्मी निकलती है, जिससे बर्थोलेट नमक का अपघटन होता है।
KClO3  केसीएल+.
केसीएल+.

परिणामी ऑक्सीजन माचिस की तीली को प्रज्वलित करने में मदद करती है।
फॉस्फोरस का उपयोग धातुकर्म में किया जाता है। इसका उपयोग कंडक्टर बनाने के लिए किया जाता है और यह कुछ धातु सामग्री, जैसे टिन कांस्य, का एक घटक है।
फॉस्फोरस का उपयोग फॉस्फोरिक एसिड और कीटनाशकों (डाइक्लोरवोस, क्लोरोफोस, आदि) के उत्पादन में भी किया जाता है।
सफेद फास्फोरस का उपयोग धुआं स्क्रीन बनाने के लिए किया जाता है, क्योंकि इसके दहन से सफेद धुआं पैदा होता है।
अध्यायद्वितीय. फास्फोरस यौगिक
2.1 ऑक्साइड
फॉस्फोरस कई ऑक्साइड बनाता है। उनमें से सबसे महत्वपूर्ण फॉस्फोरस ऑक्साइड (V) P4O10 और फॉस्फोरस ऑक्साइड (III) P4O6 हैं। अक्सर उनके सूत्र सरलीकृत रूप में लिखे जाते हैं - P2O5 और P2O3। इन ऑक्साइडों की संरचना फॉस्फोरस परमाणुओं की चतुष्फलकीय व्यवस्था को बरकरार रखती है।
फॉस्फोरस (III) ऑक्साइड P4O6 एक मोमी क्रिस्टलीय द्रव्यमान है जो 22.5°C पर पिघलता है और रंगहीन तरल में बदल जाता है। ज़हरीला.
ठंडे पानी में घुलने पर यह फॉस्फोरस एसिड बनाता है:
P4O6 + 6H2O = 4H3PO3,
और क्षार के साथ प्रतिक्रिया करते समय - संबंधित लवण (फॉस्फाइट्स)।
मजबूत कम करने वाला एजेंट। ऑक्सीजन के साथ बातचीत करते समय, यह P4O10 में ऑक्सीकृत हो जाता है।
फास्फोरस (III) ऑक्साइड ऑक्सीजन की अनुपस्थिति में सफेद फास्फोरस के ऑक्सीकरण द्वारा प्राप्त किया जाता है।
फॉस्फोरस (V) ऑक्साइड P4O10 एक सफेद क्रिस्टलीय पाउडर है। ऊर्ध्वपातन तापमान 36°C. इसमें कई संशोधन हैं, जिनमें से एक (तथाकथित अस्थिर) की संरचना P4O10 है। इस संशोधन की क्रिस्टल जाली कमजोर अंतर-आणविक बलों द्वारा एक दूसरे से जुड़े P4O10 अणुओं से बनी होती है, जो गर्म होने पर आसानी से टूट जाती हैं। इसलिए इस किस्म की अस्थिरता. अन्य संशोधन बहुलक हैं। इनका निर्माण PO4 टेट्राहेड्रा की अंतहीन परतों से होता है।
जब P4O10 पानी के साथ प्रतिक्रिया करता है, तो फॉस्फोरिक एसिड बनता है:
P4O10 + 6H2O = 4H3PO4.
एक अम्लीय ऑक्साइड होने के कारण, P4O10 क्षारीय ऑक्साइड और हाइड्रॉक्साइड के साथ प्रतिक्रिया करता है।
यह अतिरिक्त ऑक्सीजन (शुष्क हवा) में फॉस्फोरस के उच्च तापमान ऑक्सीकरण के दौरान बनता है।
अपनी असाधारण हीड्रोस्कोपिसिटी के कारण, फॉस्फोरस (वी) ऑक्साइड का उपयोग प्रयोगशाला और औद्योगिक प्रौद्योगिकी में सुखाने और निर्जलीकरण एजेंट के रूप में किया जाता है। अपने सुखाने के प्रभाव में यह अन्य सभी पदार्थों से आगे निकल जाता है। एनहाइड्राइड बनाने के लिए निर्जल पर्क्लोरिक एसिड से रासायनिक रूप से बंधे पानी को हटा दिया जाता है:
4HClO4 + P4O10 = (HPO3)4 + 2Cl2O7.
2.2 अम्ल और उनके लवण
ए) फॉस्फोरस एसिड H3PO3। निर्जल फॉस्फोरस एसिड H3PO3 1.65 ग्राम/सेमी3 घनत्व वाले क्रिस्टल बनाता है, जो 74°C पर पिघलता है।
संरचनात्मक सूत्र:
 .
.
जब निर्जल H3PO3 को गर्म किया जाता है, तो एक अनुपातहीन प्रतिक्रिया (ऑटो-ऑक्सीकरण-स्व-कमी) होती है:
4H3PO3 = PH3 + 3H3PO4.
फॉस्फोरस अम्ल के लवण - फॉस्फेट। उदाहरण के लिए, K3PO3 (पोटेशियम फ़ॉस्फाइट) या Mg3(PO3)2 (मैग्नीशियम फ़ॉस्फाइट)।
फॉस्फोरस एसिड H3PO3 फॉस्फोरस (III) ऑक्साइड को पानी में घोलकर या फॉस्फोरस (III) क्लोराइड PCl3 के हाइड्रोलिसिस द्वारा प्राप्त किया जाता है:
РCl3 + 3H2O = H3PO3 + 3HCl.
बी) फॉस्फोरिक एसिड (ऑर्थोफॉस्फोरिक एसिड) H3PO4।
निर्जल फॉस्फोरिक एसिड हल्के पारदर्शी क्रिस्टल के रूप में प्रकट होता है जो कमरे के तापमान पर हवा में फैलता है। गलनांक 42.35°C. फॉस्फोरिक एसिड पानी के साथ किसी भी सांद्रता का घोल बनाता है।
फॉस्फोरिक एसिड का निम्नलिखित संरचनात्मक सूत्र है:
 .
.
फॉस्फोरिक एसिड हाइड्रोजन तक मानक इलेक्ट्रोड क्षमता की श्रृंखला में स्थित धातुओं के साथ, मूल ऑक्साइड के साथ, क्षार के साथ और कमजोर एसिड के लवण के साथ प्रतिक्रिया करता है।
प्रयोगशाला में, फॉस्फोरस को 30% नाइट्रिक एसिड के साथ ऑक्सीकरण करके फॉस्फोरिक एसिड प्राप्त किया जाता है:
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO.
उद्योग में, फॉस्फोरिक एसिड का उत्पादन दो तरीकों से किया जाता है: निष्कर्षण और थर्मल। निष्कर्षण विधि सल्फ्यूरिक एसिड के साथ कुचले हुए प्राकृतिक फॉस्फेट के उपचार पर आधारित है:
Ca3(PO4)2 + 3H2SO4 = 2H3PO4 + 3CaSO4↓.
फिर फॉस्फोरिक एसिड को वाष्पीकरण द्वारा फ़िल्टर और केंद्रित किया जाता है।
थर्मल विधि में प्राकृतिक फॉस्फेट को मुक्त फॉस्फोरस में कम करना, इसके बाद इसे P4O10 तक जलाना और बाद वाले को पानी में घोलना शामिल है। इस विधि का उपयोग करके उत्पादित फॉस्फोरिक एसिड की विशेषता उच्च शुद्धता और बढ़ी हुई सांद्रता (वजन के अनुसार 80% तक) है।
फॉस्फोरिक एसिड का उपयोग उर्वरकों के उत्पादन, अभिकर्मकों, कार्बनिक पदार्थों को तैयार करने और धातुओं पर सुरक्षात्मक कोटिंग बनाने के लिए किया जाता है। फार्मास्यूटिकल्स और फ़ीड सांद्रण की तैयारी के लिए शुद्ध फॉस्फोरिक एसिड की आवश्यकता होती है।
फॉस्फोरिक एसिड एक मजबूत एसिड नहीं है. ट्राइबेसिक एसिड के रूप में, यह जलीय घोल में चरणबद्ध तरीके से अलग हो जाता है। पहले चरण में पृथक्करण आसान होता है।
H3PO4  एच++
एच++  (डाइहाइड्रोजन फॉस्फेट आयन);
(डाइहाइड्रोजन फॉस्फेट आयन);

 एच++
एच++  (हाइड्रोजन फॉस्फेट आयन);
(हाइड्रोजन फॉस्फेट आयन);

 एच++
एच++  (फॉस्फेट आयन).
(फॉस्फेट आयन).
फॉस्फोरिक एसिड के पृथक्करण के लिए कुल आयनिक समीकरण:
H3PO4  3H++
3H++  .
.
फॉस्फोरिक एसिड लवणों की तीन श्रृंखला बनाता है:
ए) K3PO4, Ca3(PO4)2 - त्रिप्रतिस्थापित, या फॉस्फेट;
बी) K2HPO4, CaHPO4 - विघटित, या हाइड्रोफॉस्फेट;
ग) KH2PO4, Ca(H2PO4)2 - मोनोप्रतिस्थापित, या डाइहाइड्रोजन फॉस्फेट।
मोनोप्रतिस्थापित फॉस्फेट अम्लीय होते हैं, डिबासिक फॉस्फेट थोड़े क्षारीय होते हैं, और ट्राइबेसिक फॉस्फेट क्षारीय होते हैं।
सभी क्षार धातु और अमोनियम फॉस्फेट पानी में घुलनशील हैं। फॉस्फोरिक एसिड के कैल्शियम लवणों में से केवल कैल्शियम डाइहाइड्रोजन फॉस्फेट ही पानी में घुलता है। कैल्शियम हाइड्रोजन फॉस्फेट और कैल्शियम फॉस्फेट कार्बनिक अम्लों में घुलनशील होते हैं।
गर्म होने पर, फॉस्फोरिक एसिड पहले पानी खो देता है - विलायक, फिर फॉस्फोरिक एसिड का निर्जलीकरण शुरू हो जाता है और डाइफॉस्फोरिक एसिड बनता है:
2H3PO4 = H4P2O7 + H2O.
फॉस्फोरिक एसिड का एक महत्वपूर्ण हिस्सा लगभग 260°C के तापमान पर डाइफॉस्फोरिक एसिड में परिवर्तित हो जाता है।
ग) फॉस्फोरिक एसिड (हाइपोफॉस्फोरिक एसिड) H4P2O6।
 .
.
H4P2O6 मध्यम शक्ति का टेट्राबेसिक एसिड है। भंडारण के दौरान, हाइपोफॉस्फोरिक एसिड धीरे-धीरे विघटित हो जाता है। जब इसके घोल को गर्म किया जाता है तो यह H3PO4 और H3PO3 में बदल जाता है।
यह हवा में H3PO3 के धीमे ऑक्सीकरण या नम हवा में सफेद फास्फोरस के ऑक्सीकरण के दौरान बनता है।
d) हाइपोफॉस्फोरस एसिड (हाइपोफॉस्फोरस एसिड) H3PO2। यह अम्ल मोनोबैसिक और मजबूत है। हाइपोफॉस्फोरस एसिड का निम्नलिखित संरचनात्मक सूत्र है:
 .
.
हाइपोफॉस्फाइट्स - हाइपोफॉस्फोरस एसिड के लवण - आमतौर पर पानी में अत्यधिक घुलनशील होते हैं।
हाइपोफॉस्फाइट्स और H3PO2 ऊर्जावान कम करने वाले एजेंट हैं (विशेषकर अम्लीय वातावरण में)। उनकी मूल्यवान विशेषता कुछ धातुओं (Ni, Cu, आदि) के घुले हुए लवणों को कम करके मुक्त धातु बनाने की क्षमता है:
2Ni2+ +  + 2H2O → Ni0 +
+ 2H2O → Ni0 +  + 6H+.
+ 6H+.
हाइपोफॉस्फोरस एसिड कैल्शियम या बेरियम हाइपोफॉस्फाइट्स को सल्फ्यूरिक एसिड के साथ विघटित करके प्राप्त किया जाता है:
Ba(H2PO2)2 + H2SO4 = 2H3PO2 + BaSO4↓.
कैल्शियम या बेरियम हाइड्रॉक्साइड के निलंबन में सफेद फास्फोरस को उबालने से हाइपोफॉस्फाइट्स का निर्माण होता है।
2P4 (सफेद) + 3Ba(OH)2 + 6H2O = 2PH3 + 3Ba(H2PO2)2।
2.3 फॉस्फीन
फॉस्फीन PH3 - हाइड्रोजन के साथ फास्फोरस का एक यौगिक - एक तेज, अप्रिय लहसुन गंध के साथ एक रंगहीन गैस, पानी में अत्यधिक घुलनशील (इसके साथ रासायनिक रूप से प्रतिक्रिया नहीं करता है), और बहुत जहरीली है। हवा में, शुद्ध और सूखी फॉस्फीन 100-140 डिग्री सेल्सियस से ऊपर गर्म होने पर प्रज्वलित होती है। यदि फॉस्फीन में डाइफॉस्फीन P2H4 की अशुद्धियाँ होती हैं, तो यह हवा में स्वतः ही प्रज्वलित हो जाती है।
कुछ मजबूत एसिड के साथ बातचीत करते समय, फॉस्फीन फॉस्फोनियम लवण बनाता है, उदाहरण के लिए:
PH3 + HCl = PH4Cl (फॉस्फोनियम क्लोराइड)।
फॉस्फोनियम धनायन [PH4]+ की संरचना अमोनियम धनायन + की संरचना के समान है।
पानी फॉस्फोनियम लवण को विघटित करके फॉस्फीन और हाइड्रोजन हैलाइड बनाता है।
फॉस्फाइड को पानी के साथ प्रतिक्रिया करके फॉस्फीन प्राप्त किया जा सकता है:
Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3.
और एक आखिरी बात. जब फॉस्फोरस धातुओं के साथ क्रिया करता है, तो लवण बनते हैं - फॉस्फाइड। उदाहरण के लिए, Ca3P2 (कैल्शियम फ़ॉस्फाइड), Mg3P2 (मैग्नीशियम फ़ॉस्फाइड)।
अध्याय III फास्फोरस उर्वरक
फास्फोरस यौगिक, नाइट्रोजन की तरह, प्रकृति में लगातार परिवर्तन से गुजरते हैं - फास्फोरस चक्र प्रकृति में होता है। पौधे मिट्टी से फॉस्फेट निकालते हैं और उन्हें जटिल फास्फोरस युक्त कार्बनिक पदार्थों में परिवर्तित करते हैं। ये पदार्थ पौधों के खाद्य पदार्थों के साथ पशु शरीर में प्रवेश करते हैं - तंत्रिका और मांसपेशियों के ऊतकों में प्रोटीन पदार्थों का निर्माण, हड्डियों में कैल्शियम फॉस्फेट आदि। जानवरों और पौधों की मृत्यु के बाद, फास्फोरस युक्त यौगिक सूक्ष्मजीवों की कार्रवाई के तहत विघटित हो जाते हैं। परिणामस्वरूप, फॉस्फेट बनते हैं। इस प्रकार, चित्र द्वारा व्यक्त चक्र पूरा हो गया है:
पी (जीवित जीव)  पी (मिट्टी)।
पी (मिट्टी)।
जब फास्फोरस यौगिकों को फसल की पैदावार से हटा दिया जाता है तो यह चक्र बाधित हो जाता है। मिट्टी में फास्फोरस की कमी व्यावहारिक रूप से प्राकृतिक रूप से पूरी नहीं होती है। अतः फास्फोरस उर्वरकों का प्रयोग करना आवश्यक है।
जैसा कि आप जानते हैं, खनिज उर्वरक सरल या जटिल हो सकते हैं। सरल उर्वरकों में एक पोषक तत्व युक्त उर्वरक शामिल होते हैं। जटिल उर्वरकों में कई पोषक तत्व होते हैं।
उद्योग में फॉस्फेट उर्वरकों का उत्पादन कैसे किया जाता है? प्राकृतिक फॉस्फेट पानी में नहीं घुलते हैं, और मिट्टी के घोल में खराब घुलनशील होते हैं और पौधों द्वारा खराब अवशोषित होते हैं। प्राकृतिक फॉस्फेट को पानी में घुलनशील यौगिकों में संसाधित करना रासायनिक उद्योग के लिए एक कार्य है। उर्वरक में पोषक तत्व फास्फोरस की मात्रा का आकलन फास्फोरस ऑक्साइड (V) P2O5 की सामग्री से किया जाता है।
फॉस्फेट उर्वरकों का मुख्य घटक कैल्शियम डाइहाइड्रोजन या हाइड्रोजन फॉस्फेट है। फास्फोरस पौधों में कई कार्बनिक यौगिकों का हिस्सा है। फास्फोरस पोषण पौधों की वृद्धि और विकास को नियंत्रित करता है। सबसे आम फास्फोरस उर्वरकों में शामिल हैं:
1. फॉस्फोराइट आटा - बारीक सफेद पाउडर। इसमें 18-26% P2O5 होता है।
इसे फॉस्फोराइट्स Ca3(PO4)2 को पीसकर प्राप्त किया जाता है।
फॉस्फोराइट आटा केवल कार्बनिक अम्ल युक्त पॉडज़ोलिक और पीट मिट्टी पर अवशोषित किया जा सकता है।
2. सरल सुपरफॉस्फेट - ग्रे महीन दाने वाला पाउडर। इसमें 20% तक P2O5 होता है।
यह प्राकृतिक फॉस्फेट को सल्फ्यूरिक एसिड के साथ प्रतिक्रिया करके प्राप्त किया जाता है:
Ca3(PO4)2 + 2H2SO4 = Ca(H2PO4)2 + 2CaSO4.
अधिभास्वीय
इस मामले में, Ca(H2PO4)2 और CaSO4 लवणों का मिश्रण प्राप्त होता है, जो किसी भी मिट्टी में पौधों द्वारा अच्छी तरह से अवशोषित होता है।
3. डबल सुपरफॉस्फेट (रंग और रूप साधारण सुपरफॉस्फेट के समान)।
यह फॉस्फोरिक एसिड के साथ प्राकृतिक फॉस्फेट पर क्रिया करके प्राप्त किया जाता है:
Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2.
साधारण सुपरफॉस्फेट की तुलना में, इसमें CaSO4 नहीं होता है और यह बहुत अधिक केंद्रित उर्वरक है (इसमें 50% तक P2O5 होता है)।
4. अवक्षेप - इसमें 35-40% P2O5 होता है।
कैल्शियम हाइड्रॉक्साइड के घोल के साथ फॉस्फोरिक एसिड को निष्क्रिय करके प्राप्त किया जाता है:
H3PO4 + Ca(OH)2 = CaHPO4 2H2O.
अम्लीय मिट्टी पर उपयोग किया जाता है।
5. अस्थि भोजन. यह घरेलू पशुओं की हड्डियों को संसाधित करके प्राप्त किया जाता है और इसमें Ca3(PO4)2 होता है।
6. अम्मोफॉस एक जटिल उर्वरक है जिसमें NH4H2PO4 और (NH4)2HPO4 के रूप में नाइट्रोजन (15% K तक) और फास्फोरस (58% P2O5 तक) होता है। यह अमोनिया के साथ फॉस्फोरिक एसिड को निष्क्रिय करके प्राप्त किया जाता है।
निष्कर्ष
और अंत में, मैं फॉस्फोरस के जैविक महत्व के बारे में कहना चाहूंगा। फास्फोरस मानव, पशु और पौधों के जीवों के ऊतकों का एक अभिन्न अंग है। मानव शरीर में अधिकांश फास्फोरस कैल्शियम से बंधा होता है। एक बच्चे को कंकाल बनाने के लिए कैल्शियम जितनी ही फास्फोरस की आवश्यकता होती है। हड्डियों के अलावा, फास्फोरस तंत्रिका और मस्तिष्क के ऊतकों, रक्त और दूध में पाया जाता है। पौधों में, जानवरों की तरह, फास्फोरस प्रोटीन का हिस्सा है।
फास्फोरस से जो भोजन, मुख्य रूप से अंडे, मांस, दूध और ब्रेड के साथ मानव शरीर में प्रवेश करता है, एटीपी का निर्माण होता है - एडेनोसिन ट्राइफॉस्फोरिक एसिड, जो ऊर्जा के संग्राहक और वाहक के रूप में कार्य करता है, साथ ही न्यूक्लिक एसिड - डीएनए और आरएनए, जो संचारित करते हैं। शरीर के वंशानुगत गुण. एटीपी का सेवन शरीर के सक्रिय रूप से काम करने वाले अंगों में सबसे अधिक तीव्रता से किया जाता है: यकृत, मांसपेशियां और मस्तिष्क। यह कोई आश्चर्य की बात नहीं है कि प्रसिद्ध खनिजविज्ञानी, भू-रसायन विज्ञान के संस्थापकों में से एक, शिक्षाविद ए.ई. फर्समैन ने फॉस्फोरस को "जीवन और विचार का तत्व" कहा।
जैसा कि कहा गया है, फॉस्फोरस प्रकृति में मिट्टी में पाए जाने वाले (या प्राकृतिक जल में घुले हुए) यौगिकों के रूप में मौजूद है। फास्फोरस पौधों द्वारा मिट्टी से निकाला जाता है, और जानवर पौधों के खाद्य पदार्थों से फास्फोरस प्राप्त करते हैं। पौधों और जानवरों के जीवों की मृत्यु के बाद, फास्फोरस मिट्टी में वापस आ जाता है। प्रकृति में फॉस्फोरस चक्र इसी प्रकार होता है।
ग्रंथ सूची:
अखमेतोव एन.एस. रसायन विज्ञान 9वीं कक्षा: पाठ्यपुस्तक। सामान्य शिक्षा के लिए पाठयपुस्तक प्रतिष्ठान. - दूसरा संस्करण। - एम.: शिक्षा, 1999. - 175 पी.: बीमार।
गेब्रियलियन ओ.एस. रसायन विज्ञान 9वीं कक्षा: पाठ्यपुस्तक। सामान्य शिक्षा के लिए पाठयपुस्तक प्रतिष्ठान. - चौथा संस्करण। - एम.: बस्टर्ड, 2001. - 224 पी.: बीमार।
गेब्रियलियन ओ.एस. रसायन विज्ञान ग्रेड 8-9: विधि। भत्ता. - चौथा संस्करण। - एम.: बस्टर्ड, 2001. - 128 पी.
एरोशिन डी.पी., शिश्किन ई.ए. रसायन विज्ञान में समस्याओं को हल करने के तरीके: पाठ्यपुस्तक। भत्ता. - एम.: शिक्षा, 1989. - 176 पी.: बीमार।
क्रेमेनचुगस्काया एम. रसायन विज्ञान: एक स्कूली बच्चे की संदर्भ पुस्तक। - एम.: फिलोल. सोसायटी "वर्ड": एलएलसी "एएसटी पब्लिशिंग हाउस", 2001. - 478 पी।
क्रिट्समैन वी.ए. अकार्बनिक रसायन विज्ञान पर पुस्तक पढ़ना। - एम.: शिक्षा, 1986. - 273 पी.
समान सार:
आर्सेनिक (अव्य. आर्सेनिकम), अस, मेंडेलीव की आवधिक प्रणाली के समूह V का रासायनिक तत्व, परमाणु क्रमांक 33, परमाणु द्रव्यमान 74.9216; स्टील-ग्रे क्रिस्टल। तत्व में एक स्थिर आइसोटोप होता है
सर्गुट स्टेट यूनिवर्सिटी रसायन विज्ञान विभाग सार
गर्म करने पर यह धीरे-धीरे मेटाफॉस्फोरिक एसिड में बदल जाता है:
बाइफॉस्फोरस
अम्ल
2. सिल्वर (I) नाइट्रेट के घोल के संपर्क में आने पर, एक पीला अवक्षेप दिखाई देता है:
पीला
तलछट

3. ऑर्थोफोस्फोरिक एसिड जानवरों और पौधों के जीवन में एक महत्वपूर्ण भूमिका निभाता है।इसके अवशेष एडेनोसिन ट्राइफॉस्फोरिक एसिड एटीपी का हिस्सा हैं।
जब एटीपी टूटता है, तो बड़ी मात्रा में ऊर्जा निकलती है।
ऑर्थोफॉस्फेट्स. फॉस्फोरिक एसिड लवणों की तीन श्रृंखला बनाता है। यदि हम धातु के परमाणुओं को मी अक्षर से नामित करें, तो हम इसके लवणों की संरचना को सामान्य रूप में चित्रित कर सकते हैं (तालिका 3)।
टेबल तीन
धातु युक्त ऑर्थोफॉस्फेट के रासायनिक सूत्र
|
मोनोवैलेन्ट |
द्विसंयोजक |
त्रिसंयोजक |
|
ऑर्थोफॉस्फेट्स मी 3 (पीओ 4) 2 |
मैं 3 पीओ 4 |
|
|
|
हाइड्रोजन ऑर्थोफोस्फेट |
मी 2 (एनआरओ 4) 3 |
|
|
डाइहाइड्रोजन ऑर्थोफोस्फेट्स मैं(एच 2 पीओ 4) 2 |
मैं (एच 2 पीओ 4) 3 |
एक मोनोवैलेंट धातु के बजाय, ऑर्थोफॉस्फेट अणुओं की संरचना में एक अमोनियम समूह शामिल हो सकता है: (एनएच 4) 3 पीओ 4 - अमोनियम ऑर्थोफॉस्फेट;
(एनएच 4) 2 एचपीओ 4 - अमोनियम हाइड्रोजन ऑर्थोफॉस्फेट; एनएच 4 एच 2 पीओ 4 - अमोनियम डाइहाइड्रोजन ऑर्थोफोस्फेट।
कैल्शियम और अमोनियम ऑर्थोफॉस्फेट और हाइड्रोऑर्थोफॉस्फेट का व्यापक रूप से उर्वरक के रूप में उपयोग किया जाता है, और सोडियम ऑर्थोफॉस्फेट और सोडियम हाइड्रोजनऑर्थोफॉस्फेट का उपयोग पानी से कैल्शियम लवण को निकालने के लिए किया जाता है।
मानव शरीर में फास्फोरस
70 किलो वजन वाले मानव शरीर में। इसमें लगभग 780 ग्राम फॉस्फोरस होता है। फॉस्फोरस मानव और जानवरों की हड्डियों में कैल्शियम फॉस्फेट के रूप में मौजूद होता है। यह प्रोटीन, फॉस्फोलिपिड और न्यूक्लिक एसिड का भी हिस्सा है; फॉस्फोरस यौगिक ऊर्जा चयापचय (एडेनसिन ट्राइफॉस्फोरिक एसिड, एटीपी) में शामिल होते हैं। फास्फोरस के लिए मानव शरीर की दैनिक आवश्यकता 1.2 ग्राम है। हम इसकी मुख्य मात्रा दूध और ब्रेड के साथ खाते हैं (100 ग्राम ब्रेड में लगभग 200 मिलीग्राम फास्फोरस होता है)। मछली, फलियाँ और कुछ प्रकार के पनीर फास्फोरस से भरपूर होते हैं।
दिलचस्प बात यह है कि उचित पोषण के लिए फास्फोरस और कैल्शियम की खपत की मात्रा के बीच संतुलन बनाए रखना आवश्यक है: इन खाद्य तत्वों में इष्टतम अनुपात 1.51 है। फास्फोरस युक्त खाद्य पदार्थों की अधिकता से हड्डियों से कैल्शियम निकल जाता है और अधिक कैल्शियम से यूरोलिथियासिस विकसित हो जाता है।
माचिस
माचिस की जलती हुई सतह को लाल फास्फोरस और कांच के पाउडर के मिश्रण से लेपित किया जाता है। माचिस हेड की संरचना में ऑक्सीकरण एजेंट (PbO 2, KСlO 3, BaCrO 4) और कम करने वाले एजेंट (S, Sb 2 S 3) शामिल हैं। जब इग्निशन सतह से घर्षण होता है, तो माचिस पर लगाया गया मिश्रण प्रज्वलित हो जाता है:पहली फॉस्फोरस माचिस - सफेद फॉस्फोरस से बने सिर के साथ - केवल 1827 में बनाई गई थी। ऐसी माचिस किसी भी सतह पर रगड़ने पर प्रज्वलित हो जाती थी, जिससे अक्सर आग लग जाती थी। इसके अलावा, सफेद फास्फोरस बहुत जहरीला होता है। फॉस्फोरस माचिस के साथ विषाक्तता के मामलों का वर्णन किया गया है, दोनों लापरवाही से निपटने के कारण और आत्महत्या के उद्देश्य से: इसके लिए कुछ माचिस की तीली खाना ही काफी था। इसीलिए फॉस्फोरस माचिस की जगह सुरक्षित माचिस ने ले ली, जो आज भी ईमानदारी से हमारी सेवा करती है। सेफ्टी माचिस का औद्योगिक उत्पादन 60 के दशक में स्वीडन में शुरू हुआ। XIX सदी।
फास्फोरस उर्वरक
खनिज उर्वरक पौधों और मिट्टी के गुणों के लिए विभिन्न पोषक तत्वों का एक स्रोत हैं, मुख्य रूप से नाइट्रोजन, फास्फोरस और पोटेशियम, और फिर कैल्शियम, मैग्नीशियम, सल्फर, लोहा।
फास्फोरस पौधों में कई कार्बनिक यौगिकों का हिस्सा है। फास्फोरस पोषण पौधों की वृद्धि और विकास को नियंत्रित करता है।
फॉस्फेट उर्वरकों, फास्फोरस और सभी फास्फोरस यौगिकों के उत्पादन के लिए कच्चे माल एपेटाइट और फॉस्फेट अयस्क हैं। एपेटाइट्स की संरचना को अक्सर सूत्र Ca 5 (PO 4) 3 F (फ्लोरापेटाइट) द्वारा व्यक्त किया जाता है। फॉस्फोराइट्स फ्लोरापैटाइट्स से इस मायने में भिन्न होते हैं कि उनमें एफ-आयनों के बजाय ओएच-या होता है  . फॉस्फोराइट्स में आमतौर पर फ्लोरापैटाइट की तुलना में अधिक अशुद्धियाँ होती हैं।
. फॉस्फोराइट्स में आमतौर पर फ्लोरापैटाइट की तुलना में अधिक अशुद्धियाँ होती हैं।
पूर्व-क्रांतिकारी रूस में, निम्न-गुणवत्ता वाले फॉस्फोराइट्स के केवल पतले भंडार ही ज्ञात और विकसित थे। इसलिए, 1920 के दशक में खिबिनी पर्वत में कोला प्रायद्वीप पर एपेटाइट जमा की खोज अत्यधिक राष्ट्रीय आर्थिक महत्व की एक घटना थी। यहां एक बड़ा प्रसंस्करण संयंत्र बनाया गया है, जो खनन की गई चट्टान को उच्च फॉस्फोरस सामग्री और अशुद्धियों के साथ एक सांद्रण में अलग करता है - "नेफलाइन टेलिंग्स", जिसका उपयोग एल्यूमीनियम, सोडा, पोटाश और सीमेंट का उत्पादन करने के लिए किया जाता है।
दक्षिणी कजाकिस्तान में कराताउ पर्वत में फॉस्फोराइट्स के शक्तिशाली भंडार की खोज की गई है।
सबसे सस्ता फॉस्फोरस उर्वरक बारीक पिसा हुआ फॉस्फोराइट - फॉस्फेट रॉक है। इसमें फास्फोरस जल-अघुलनशील कैल्शियम फॉस्फेट Ca 3 (PO 4) 2 के रूप में निहित होता है। इसलिए, फॉस्फोराइट्स सभी पौधों द्वारा और सभी मिट्टी पर अवशोषित नहीं होते हैं। खनन किए गए अधिकांश फॉस्फोरस अयस्कों को रासायनिक तरीकों से किसी भी मिट्टी पर सभी पौधों के लिए उपलब्ध पदार्थों में संसाधित किया जाता है। ये पानी में घुलनशील कैल्शियम फॉस्फेट हैं:
डबल सुपरफॉस्फेट(रंग और स्वरूप साधारण सुपरफॉस्फेट के समान - ग्रे महीन दाने वाला पाउडर)।
यह फॉस्फोरिक एसिड के साथ प्राकृतिक फॉस्फेट पर क्रिया करके प्राप्त किया जाता है:
साधारण सुपरफॉस्फेट की तुलना में, इसमें CaSO 4 नहीं होता है और यह एक महत्वपूर्ण रूप से केंद्रित उर्वरक है (इसमें 50% P 2 O 5 तक होता है)।
तलछट– इसमें 35-40% पी 2 ओ 5 होता है।
कैल्शियम हाइड्रॉक्साइड के घोल के साथ फॉस्फोरिक एसिड को निष्क्रिय करके प्राप्त किया जाता है:
अम्लीय मिट्टी पर उपयोग किया जाता है।
अम्मोफोस – जटिल एनएच 4 एच 2 पीओ 4 और (एनएच 4) 2 एचपीओ 4 के रूप में नाइट्रोजन (15% एन तक) और फास्फोरस (58% पी 2 ओ 5 तक) युक्त उर्वरक। यह अमोनिया के साथ फॉस्फोरिक एसिड को निष्क्रिय करके प्राप्त किया जाता है।
पहले, 100 से अधिक वर्षों से, तथाकथित सरल सुपरफॉस्फेट, जो प्राकृतिक कैल्शियम फॉस्फेट पर सल्फ्यूरिक एसिड की क्रिया से बनता है:
इस मामले में, कैल्शियम फॉस्फेट के साथ फॉस्फोरिक एसिड का उत्पादन करने की तुलना में अपेक्षाकृत कम सल्फ्यूरिक एसिड प्रतिक्रिया करता है। परिणाम कैल्शियम डाइहाइड्रोजन फॉस्फेट और कैल्शियम सल्फेट का मिश्रण है। यह एक उर्वरक है जिसका द्रव्यमान अंश P 2 O 5 20% से अधिक नहीं है। अब साधारण सुपरफॉस्फेट का उत्पादन पहले से निर्मित संयंत्रों में अपेक्षाकृत छोटे पैमाने पर किया जाता है।
जटिल रचना. इसमें P, Ca, Si, C, Fe और अन्य तत्व शामिल हैं
जटिल
अम्मोफोस
अम्मोफ़ोस्का
नाइट्रोअम्मोफोस
निष्कर्ष
फास्फोरस मूल्य
ऑर्थोफॉस्फोरिक एसिड के व्युत्पन्न न केवल पौधों के लिए, बल्कि जानवरों के लिए भी बहुत आवश्यक हैं। अधिकांश जीवित जीवों की हड्डियाँ, दाँत, खोल, पंजे, सुइयाँ और रीढ़ मुख्य रूप से कैल्शियम ऑर्थोफॉस्फेट से बने होते हैं। इसके अलावा, ऑर्थोफॉस्फोरिक एसिड, कार्बनिक पदार्थों के साथ विभिन्न यौगिक बनाकर, पर्यावरण के साथ जीवित जीव की चयापचय प्रक्रियाओं में सक्रिय रूप से भाग लेता है। परिणामस्वरूप, फास्फोरस व्युत्पन्न मनुष्यों और जानवरों की हड्डियों, मस्तिष्क, रक्त, मांसपेशियों और संयोजी ऊतकों में पाए जाते हैं। तंत्रिका (मस्तिष्क) कोशिकाओं की संरचना में विशेष रूप से बहुत अधिक ऑर्थोफॉस्फोरिक एसिड होता है, जो ए.ई. की अनुमति देता है। प्रसिद्ध भू-रसायनज्ञ फर्समैन 1 ने फॉस्फोरस को "विचार का तत्व" कहा। आहार में फॉस्फोरस यौगिकों की मात्रा में कमी या अपचनीय रूप में उनका परिचय शरीर की स्थिति (रिकेट्स, एनीमिया, आदि के साथ पशु रोग) पर बहुत नकारात्मक प्रभाव डालता है।
फास्फोरस का प्रयोग
खाद्य उद्योग ऑर्थोफॉस्फोरिक एसिड की बहुत अधिक खपत करता है। तथ्य यह है कि पतला ऑर्थोफोस्फोरिक एसिड का स्वाद बहुत सुखद होता है और मुरब्बा, नींबू पानी और सिरप में इसकी थोड़ी मात्रा मिलाने से उनका स्वाद काफी बेहतर हो जाता है। फॉस्फोरिक एसिड के कुछ लवणों में भी यह गुण होता है। उदाहरण के लिए, कैल्शियम हाइड्रोजन फॉस्फेट को लंबे समय से बेकिंग पाउडर में शामिल किया गया है, जिससे बन्स और ब्रेड का स्वाद बेहतर हो जाता है।
ऑर्थोफॉस्फोरिक एसिड के अन्य औद्योगिक अनुप्रयोग भी दिलचस्प हैं। उदाहरण के लिए, यह देखा गया कि एसिड और उसके लवण के साथ लकड़ी का संसेचन लकड़ी को गैर-ज्वलनशील बनाता है। इस आधार पर, अब अग्निरोधी पेंट, गैर-ज्वलनशील फॉस्फोरस लकड़ी के बोर्ड, गैर-ज्वलनशील फॉस्फेट फोम और अन्य निर्माण सामग्री का उत्पादन किया जाता है।
फॉस्फोरिक एसिड के विभिन्न लवणों का व्यापक रूप से कई उद्योगों में, निर्माण में, प्रौद्योगिकी के विभिन्न क्षेत्रों में, सार्वजनिक उपयोगिताओं और रोजमर्रा की जिंदगी में, विकिरण से सुरक्षा के लिए, पानी को नरम करने, बॉयलर स्केल का मुकाबला करने और विभिन्न डिटर्जेंट बनाने के लिए उपयोग किया जाता है।
फॉस्फोरिक एसिड, संघनित एसिड और निर्जलित फॉस्फेट हाइड्रोकार्बन के निर्जलीकरण, क्षारीकरण और पोलीमराइजेशन की प्रक्रियाओं में उत्प्रेरक के रूप में काम करते हैं।
ऑर्गनोफॉस्फोरस यौगिक प्रशीतन इकाइयों में अर्क, प्लास्टिसाइज़र, स्नेहक, पाउडर योजक और अवशोषक के रूप में एक विशेष स्थान रखते हैं। एसिड एल्काइल फॉस्फेट के लवण का उपयोग सर्फेक्टेंट, एंटीफ्रीज, विशेष उर्वरक, लेटेक्स एंटीकोआगुलंट्स आदि के रूप में किया जाता है। एसिड एल्काइल फॉस्फेट का उपयोग यूरेनियम अयस्क शराब के निष्कर्षण प्रसंस्करण के लिए किया जाता है।
प्रयुक्त साहित्य की सूची:
एफ.जी.फेल्डमैन, जी.ई.रुडजाइटिस। रसायन विज्ञान। सामान्य शिक्षा संस्थानों की 9वीं कक्षा के लिए पाठ्यपुस्तक। - एम., 5वां संस्करण, एनलाइटनमेंट, 1997।
रसायन विज्ञान। संदर्भ सामग्री। यू.डी. ट्रेटीकोव द्वारा संपादित, - एम., शिक्षा, 1984।
रसायन विज्ञान। स्कूली बच्चों की पुस्तिका, - एम., 1995।
रसायन विज्ञान। बच्चों के लिए विश्वकोश. खंड 17, अवंता, 2000।
वेसर डब्ल्यू.-जे., फास्फोरस और उसके यौगिक, ट्रांस. अंग्रेजी से, - एम., 1963।
इंटरनेट: http://school-sector.relarn.ru/nsm/chemistry/
1 फ़र्समैन अलेक्जेंडर एवगेनिविच, सोवियत भू-रसायनज्ञ और खनिजविज्ञानी, यूएसएसआर एकेडमी ऑफ साइंसेज के शिक्षाविद (1919)। वी.आई. वर्नाडस्की के छात्र।
फास्फोरस (पी)- मुक्त अवस्था में अधिक सक्रियता के कारण यह प्रकृति में नहीं होता है।
इलेक्ट्रॉनिक विन्यास 1S 2 2S 2 2P 6 3S 2 3P 3
फॉस्फोरस मध्यम सक्रियता वाली एक अधातु (जिसे पहले उपधातु कहा जाता था) है। फॉस्फोरस परमाणु की बाहरी कक्षा में पाँच इलेक्ट्रॉन होते हैं, जिनमें से तीन अयुग्मित होते हैं। इसलिए, यह 3-, 3+ और 5+ की संयोजकता प्रदर्शित कर सकता है।
फॉस्फोरस के लिए 5+ की संयोजकता प्रदर्शित करने के लिए, परमाणु पर कुछ प्रभाव आवश्यक है, जो अंतिम कक्षा के दो युग्मित इलेक्ट्रॉनों को अयुग्मित इलेक्ट्रॉनों में बदल देगा।
फॉस्फोरस को अक्सर बहुआयामी तत्व कहा जाता है। दरअसल, विभिन्न परिस्थितियों में यह अलग-अलग व्यवहार करता है, या तो ऑक्सीडेटिव या कम करने वाले गुणों का प्रदर्शन करता है। फॉस्फोरस की बहुमुखी प्रतिभा में कई एलोट्रोपिक संशोधनों में मौजूद रहने की क्षमता भी शामिल है।
प्रकृति में वितरण
फॉस्फोरस प्रकृति में व्यापक है और पृथ्वी की पपड़ी का 0.12% बनाता है। यह पौधे और पशु मूल के प्रोटीन का हिस्सा है। मानव कंकाल में लगभग 1400 ग्राम फास्फोरस, मांसपेशियां - 130 ग्राम, मस्तिष्क और तंत्रिकाएं - 12 ग्राम होते हैं। फास्फोरस पौधों की रासायनिक संरचना में एक महत्वपूर्ण अनुपात बनाता है और इसलिए एक महत्वपूर्ण उर्वरक है। उर्वरकों के उत्पादन के लिए मुख्य कच्चा माल एपेटाइट CaF 2 Ch3Ca 3 (PO 4) 2 और फॉस्फोराइट्स हैं, जिनका आधार कैल्शियम फॉस्फेट Ca 3 (PO 4) 2 है। एलिमेंटल फॉस्फोरस SiO 2 की उपस्थिति में फॉस्फोराइट्स और एपेटाइट्स से 1400-1600 डिग्री सेल्सियस पर इलेक्ट्रोथर्मल कमी द्वारा प्राप्त किया जाता है। एपेटाइट का खनन रूस, ब्राजील, फिनलैंड और स्वीडन में किया जाता है। फॉस्फोरस का एक प्रमुख स्रोत फॉस्फेट अयस्क है, जिसका खनन संयुक्त राज्य अमेरिका, मोरक्को, ट्यूनीशिया, अल्जीरिया, मिस्र और इज़राइल में बड़ी मात्रा में किया जाता है। फॉस्फोरस का एक अन्य स्रोत गुआनो, फिलीपींस, सेशेल्स, केन्या और नामीबिया में खनन किया जाता है।
सबसे महत्वपूर्ण एलोट्रोपिक संशोधन
सफेद फास्फोरस.शायद तत्व संख्या 15 का सबसे प्रसिद्ध संशोधन नरम, मोमी, सफेद या पीला फॉस्फोरस है। यह ब्रांड ही था जिसने इसकी खोज की थी, और इसके गुणों के कारण तत्व को इसका नाम मिला: ग्रीक में "फॉस्फोरस" का अर्थ चमकदार, चमकदार होता है। सफेद फॉस्फोरस अणु में टेट्राहेड्रोन के आकार में व्यवस्थित चार परमाणु होते हैं। घनत्व 1.83, गलनांक 44.1°C, क्वथनांक 280°C, सफेद फास्फोरस जहरीला, अत्यंत प्रतिक्रियाशील और आसानी से ऑक्सीकरण हो जाता है। कार्बन डाइसल्फ़ाइड, तरल अमोनिया और एसओ 2, बेंजीन, ईथर, अस्थिर में घुलनशील। इसमें लहसुन की तीखी गंध होती है। पानी में लगभग अघुलनशील. अंधेरे में चमकता है.
लाल फास्फोरस.जब 250 डिग्री सेल्सियस से ऊपर हवा की पहुंच के बिना गर्म किया जाता है, तो सफेद फास्फोरस लाल रंग में बदल जाता है। यह पहले से ही एक बहुलक है, लेकिन बहुत व्यवस्थित संरचना नहीं है। लाल फास्फोरस की प्रतिक्रियाशीलता सफेद फास्फोरस की तुलना में काफी कम होती है। यह अंधेरे में चमकता नहीं है और कार्बन डाइसल्फ़ाइड में नहीं घुलता है। (इसमें हमेशा थोड़ी मात्रा में सफेद फास्फोरस होता है, जिसके परिणामस्वरूप यह जहरीला हो सकता है।) इसका घनत्व बहुत अधिक है, इसकी संरचना महीन-क्रिस्टलीय है। गंधहीन, लाल-भूरा रंग। परमाणु क्रिस्टल जाली बहुत जटिल होती है, आमतौर पर अनाकार। पानी और कार्बनिक सॉल्वैंट्स में अघुलनशील। स्थिर। भौतिक गुण तैयारी की विधि पर निर्भर करते हैं।
काला फास्फोरस- धात्विक चमक वाला एक बहुलक पदार्थ, ग्रेफाइट के समान, गंधहीन, स्पर्श करने पर चिकना। पानी और कार्बनिक सॉल्वैंट्स में अघुलनशील। परमाणु क्रिस्टल जाली, अर्धचालक। t°उबलना= 453°С (ऊर्ध्वपातन), t°पिघलना= 1000°C (p=1.8 * 10 9 Pa पर), स्थिर।


फॉस्फोरस के अन्य, और भी अधिक उच्च-आणविक संशोधनों के बारे में कम ज्ञात है - बैंगनी और भूरा, जो आणविक भार और मैक्रोमोलेक्यूल्स के क्रम की डिग्री में एक दूसरे से भिन्न होते हैं। ये संशोधन प्रयोगशाला विदेशी हैं और, सफेद और लाल फास्फोरस के विपरीत, अभी तक व्यावहारिक अनुप्रयोग नहीं मिला है।

 2पी 2 +5 ओ 5
2पी 2 +5 ओ 5
 फॉस्फोरस का सफेद संशोधनवाष्प के संघनन से उत्पन्न होने वाले पदार्थ में एक आणविक क्रिस्टल जाली होती है, जिसके नोड्स में P4 अणु स्थित होते हैं (चित्र 1)। अंतर-आणविक बलों की कमजोरी के कारण, सफेद फास्फोरस अस्थिर, गलने योग्य होता है, चाकू से काटा जा सकता है और कार्बन डाइसल्फ़ाइड जैसे गैर-ध्रुवीय सॉल्वैंट्स में घुल जाता है। सफेद फास्फोरस एक अत्यंत प्रतिक्रियाशील पदार्थ है। यह ऑक्सीजन, हैलोजन, सल्फर और धातुओं के साथ तीव्रता से प्रतिक्रिया करता है। हवा में फास्फोरस का ऑक्सीकरण ताप और चमक के साथ होता है। इसलिए, सफेद फास्फोरस पानी के नीचे जमा हो जाता है, जिसके साथ यह प्रतिक्रिया नहीं करता है। सफेद फास्फोरस अत्यंत विषैला होता है।
फॉस्फोरस का सफेद संशोधनवाष्प के संघनन से उत्पन्न होने वाले पदार्थ में एक आणविक क्रिस्टल जाली होती है, जिसके नोड्स में P4 अणु स्थित होते हैं (चित्र 1)। अंतर-आणविक बलों की कमजोरी के कारण, सफेद फास्फोरस अस्थिर, गलने योग्य होता है, चाकू से काटा जा सकता है और कार्बन डाइसल्फ़ाइड जैसे गैर-ध्रुवीय सॉल्वैंट्स में घुल जाता है। सफेद फास्फोरस एक अत्यंत प्रतिक्रियाशील पदार्थ है। यह ऑक्सीजन, हैलोजन, सल्फर और धातुओं के साथ तीव्रता से प्रतिक्रिया करता है। हवा में फास्फोरस का ऑक्सीकरण ताप और चमक के साथ होता है। इसलिए, सफेद फास्फोरस पानी के नीचे जमा हो जाता है, जिसके साथ यह प्रतिक्रिया नहीं करता है। सफेद फास्फोरस अत्यंत विषैला होता है। लंबे समय तक भंडारण के दौरान, साथ ही गर्म करने पर, सफेद फास्फोरस बन जाता है लाल संशोधन में(यह पहली बार 1847 में ही प्राप्त हुआ था)। लाल फॉस्फोरस नाम कई संशोधनों को संदर्भित करता है जो घनत्व और रंग में भिन्न होते हैं: यह नारंगी से गहरे लाल और यहां तक कि बैंगनी तक होता है। लाल फास्फोरस की सभी किस्में कार्बनिक सॉल्वैंट्स में अघुलनशील होती हैं, और सफेद फास्फोरस की तुलना में, वे कम प्रतिक्रियाशील होती हैं और एक बहुलक संरचना होती हैं: ये P4 टेट्राहेड्रा हैं जो अंतहीन श्रृंखलाओं में एक दूसरे से जुड़े होते हैं (चित्र 2)।
लंबे समय तक भंडारण के दौरान, साथ ही गर्म करने पर, सफेद फास्फोरस बन जाता है लाल संशोधन में(यह पहली बार 1847 में ही प्राप्त हुआ था)। लाल फॉस्फोरस नाम कई संशोधनों को संदर्भित करता है जो घनत्व और रंग में भिन्न होते हैं: यह नारंगी से गहरे लाल और यहां तक कि बैंगनी तक होता है। लाल फास्फोरस की सभी किस्में कार्बनिक सॉल्वैंट्स में अघुलनशील होती हैं, और सफेद फास्फोरस की तुलना में, वे कम प्रतिक्रियाशील होती हैं और एक बहुलक संरचना होती हैं: ये P4 टेट्राहेड्रा हैं जो अंतहीन श्रृंखलाओं में एक दूसरे से जुड़े होते हैं (चित्र 2)। फॉस्फोरस का सबसे स्थिर संशोधन है काला फास्फोरस. यह t=220 0 C और ऊंचे दबाव पर सफेद फास्फोरस के एलोट्रोपिक परिवर्तन द्वारा प्राप्त किया जाता है। दिखने में यह ग्रेफाइट जैसा दिखता है। काले फास्फोरस की क्रिस्टल संरचना स्तरित होती है, जिसमें नालीदार परतें होती हैं (चित्र 3)। काला फास्फोरस फास्फोरस का सबसे कम सक्रिय संशोधन है। हवा तक पहुंच के बिना गर्म करने पर, यह लाल की तरह भाप में बदल जाता है, जिससे यह सफेद फास्फोरस में संघनित हो जाता है।
फॉस्फोरस का सबसे स्थिर संशोधन है काला फास्फोरस. यह t=220 0 C और ऊंचे दबाव पर सफेद फास्फोरस के एलोट्रोपिक परिवर्तन द्वारा प्राप्त किया जाता है। दिखने में यह ग्रेफाइट जैसा दिखता है। काले फास्फोरस की क्रिस्टल संरचना स्तरित होती है, जिसमें नालीदार परतें होती हैं (चित्र 3)। काला फास्फोरस फास्फोरस का सबसे कम सक्रिय संशोधन है। हवा तक पहुंच के बिना गर्म करने पर, यह लाल की तरह भाप में बदल जाता है, जिससे यह सफेद फास्फोरस में संघनित हो जाता है। फॉस्फोरिक एसिड.
फॉस्फोरस युक्त अनेक अम्ल ज्ञात हैं। उनमें से सबसे महत्वपूर्ण ऑर्थोफॉस्फोरिक एसिड एच 3 पीओ 4 (चित्र 5) है।
फॉस्फोरिक एसिड.
फॉस्फोरस युक्त अनेक अम्ल ज्ञात हैं। उनमें से सबसे महत्वपूर्ण ऑर्थोफॉस्फोरिक एसिड एच 3 पीओ 4 (चित्र 5) है।